
在实验室中,将含有15.3 g过氧化氢的溶液与少量二氧化锰混合,求过氧化氢完全分解后,生成的氧气的质量是多少?
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 温度 盐 溶解度 |
10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 23、冰岛南部的艾雅法拉火山于2010年3月至4月接连两次爆发,岩浆融化冰盖引发的洪水以及火山喷发释放出的大量气体、火山灰对航空运输、气候和人体健康均受到长期影响.
23、冰岛南部的艾雅法拉火山于2010年3月至4月接连两次爆发,岩浆融化冰盖引发的洪水以及火山喷发释放出的大量气体、火山灰对航空运输、气候和人体健康均受到长期影响.查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
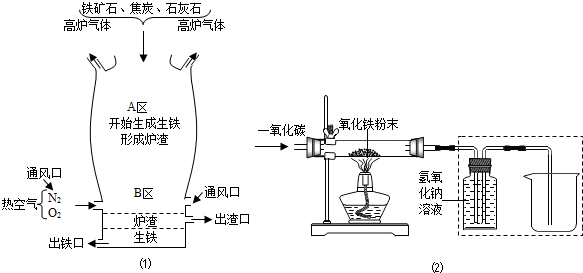
| 物质 性质 |
四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com