由某物质R和Na2SO4组成的固体混合物放入足量水中,充分搅拌,过滤后得到白色沉淀11.65g,经试验,该白色沉淀不溶于稀硝酸,滤液呈碱性.加入稀盐酸中和滤液,当加入146g,质量分数为5%的盐酸时溶液恰好呈中性.求物质R的质量.
【答案】
分析:常见的不溶于稀硝酸的白色沉淀为硫酸钡和氯化银,此白色沉淀为R和硫酸钠反应生成,故为硫酸钡,滤液呈碱性,可推知R为碱,故R为氢氧化钡.要求氢氧化钡的质量,需通过计算分析题意氢氧化钡都参与了哪些反应.
解答:解:法一:由题意知R为Ba(OH)
2,设与硫酸钠反应的Ba(OH)
2的质量为x,生成NaOH的质量为y.
Ba(OH)
2+Na
2SO
4=BaSO
4↓+2NaOH
171 233 80
x 11.65g y
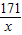
=
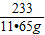
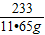
=
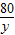
解得x=8.55g y=4.00g
设4.00gNaOH消耗HCl的质量为z.
HCl+NaOH=NaCl+H
2O
36.5 40
z 4.00g
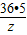
=
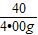
解得z=3.65g
向滤液中共加入盐酸的质量为146g×5%=7.3g,而与氢氧化钠反应的盐酸的质量为3.65g,所以HCl还与剩余的Ba(OH)
2反应.设剩余的Ba(OH)
2的质量为w.
Ba(OH)
2+2HCl=BaCl
2+2H
2O
171 73
w 7.3g-3.65g
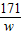
=
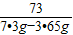
解得w=8.55g
所以共有氢氧化钡的质量为:8.55g+8.55g=17.1g
法二:由方程式Ba(OH)
2+Na
2SO
4=BaSO
4↓+2NaOH HCl+NaOH=NaCl+H
2O可得:
Ba(OH)
2--2HCl
171 73
x 146g×5%
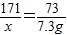
x=17.1g
答:物质R即氢氧化钡的质量为17.1g.
点评:此题考查了酸与碱的中和反应间的计算问题,完成此题,要认真分析题干给出的条件,明确题中所发生的反应,根据给出的数据进行计算.本题的易错点就是只计算与硫酸钠反应的氢氧化钡的质量,而忽视了剩余的与盐酸反应的 氢氧化钡的质量.

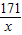 =
=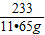
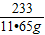 =
=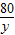
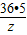 =
=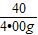
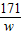 =
=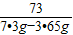
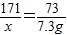


 阅读快车系列答案
阅读快车系列答案