将4.87g部分氧化的锌片溶于50g稀H2SO4中,恰好完全反应,反应称得溶液质量为54.77g.
求(1)锌片中单质锌的质量.
(2)生成物溶液中溶质的质量分数.(计算结果如除不尽保留一位小数)
【答案】
分析:分析题中所发生的变化可知,反应放出氢气造成反应前后物质总质量不相等,因此,利用质量守恒先计算出恰好完全反应时所放出氢气的质量;然后根据反应放出氢气的质量计算寻酸反应锌的质量及生成硫酸锌的质量;接下来由锌片质量与锌质量差求得氧化锌,由氧化锌计算与酸反应生成的硫酸锌;两部分硫酸锌的质量与反应后所得溶液的质量比计算生成物溶液中溶质的质量分数.
解答:解:根据质量守恒定律,反应生成氢气的质量=4.87g+50g-54.77g=0.1g
设锌片中单质锌的质量为x,反应生成硫酸锌的质量为y
Zn+H
2SO
4═ZnSO
4+H
2↑
65 161 2
x y 0.1g

=

x=3.25g

=

y=8.05g
锌片中的氧化锌的质量=4.87g-3.25g=1.62g
设锌片中氧化锌与硫酸完全反应生成硫酸锌的质量为z
ZnO+H
2SO
4═ZnSO
4+H
2O
81 161
1.62g z

z=3.22g
生成物溶液中溶质的质量分数=
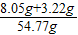
×100%≈20.6%
答:(1)锌片中单质锌的质量3.25g;(2)生成物溶液中溶质的质量分数约为20.6%.
点评:解答本题时需要注意到锌片氧化后的氧化锌也能与硫酸反应,且生成硫酸锌.

 =
= x=3.25g
x=3.25g =
= y=8.05g
y=8.05g z=3.22g
z=3.22g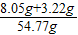 ×100%≈20.6%
×100%≈20.6%
