
分析 (1)生石灰与水反应生成氢氧化钙,结合测定溶液pH的方法,进行分析解答.
(2)熟石灰与硫酸反应生成硫酸钙和水,进行分析解答.
(3)①根据碳酸钾与氢氧化钙反应生成碳酸钙沉淀和氢氧化钾,进行分析解答.
②根据“黑白粉”中含有植物生长必须的营养元素钾元素,进行分析解答.
解答 解:(1)生石灰与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2.
用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.
(2)熟石灰与硫酸反应生成硫酸钙和水,反应的化学方程式为:Ca(OH)2+H2SO4═CaSO4+2H2O.
(3)①碳酸钾与氢氧化钙反应生成碳酸钙沉淀和氢氧化钾,反应的化学方程式为:Ca(OH)2+K2CO3═CaCO3↓+2KOH.
②“黑白粉”中含有植物生长必须的营养元素钾元素,则“黑白粉”还可提供植物必需的营养素是K.
故答案为:(1)CaO+H2O═Ca(OH)2;用玻璃棒蘸取少量待测液滴在干燥的pH试纸上;
(2)Ca(OH)2+H2SO4═CaSO4+2H2O;
(3)①Ca(OH)2+K2CO3═CaCO3↓+2KOH;②K.
点评 本题难度不大,掌握盐的化学性质、生石灰与水反应生成氢氧化钙、测定溶液pH的方法等是正确解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
| A. | 分子间有间隙 | B. | 分子很小 | ||
| C. | 分子可以再分 | D. | 分子在不断地运动 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 火星上也有季节变化 | |
| B. | 火星上一年的时间约为180天 | |
| C. | 汽油在火星上可以正常燃烧 | |
| D. | 火星表层上的成分与地球上土壤成分相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂所用的试剂和方法 | |
| A | H2 | HCl气体 | 先通过NaOH溶液,再通过浓硫酸 |
| B | NaOH溶液 | Ca(OH)2溶液 | 先加入过量的Na2CO3溶液、过滤 |
| C | CO2气体 | CO气体 | 点燃 |
| D | CaO固体 | CaCO3固体 | 加入适量的稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 试剂 | 操作 |
| A | Fe | Fe2O3 | 盐酸 | 结晶 |
| B | NH4HCO3 | NaCl | 加热 | |
| C | Cu(NO3)2溶液 | BaCl2 | AgNO3溶液 | 过滤 |
| D | CO2 | 水蒸气 | 浓硫酸 | 干燥 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
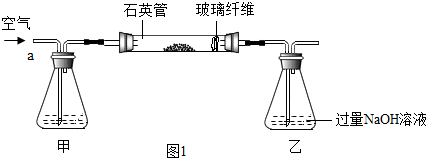


查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 代表氢原子,
代表氢原子,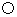 代表氧原子,这两种元素组成的化合物在一定条件下能发生以下反应,反应前后的微观模拟图如下:
代表氧原子,这两种元素组成的化合物在一定条件下能发生以下反应,反应前后的微观模拟图如下: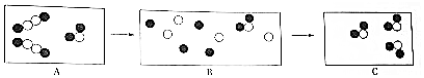
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
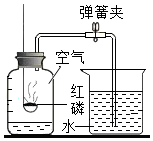 空气中氧气含量的测定
空气中氧气含量的测定查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com