
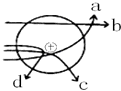
 卢瑟福的α粒子(带正电荷)轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了基础.如图线条中,最能说明原子核带正电且质量较大的轨迹是
卢瑟福的α粒子(带正电荷)轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了基础.如图线条中,最能说明原子核带正电且质量较大的轨迹是 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:初中化学 来源: 题型:
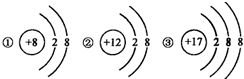 20、
20、 人类对原子结构的认识永无止境.
人类对原子结构的认识永无止境.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
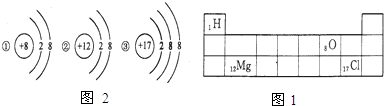 人类对原子结构的认识永无止境.
人类对原子结构的认识永无止境.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com