

分析 (1)依据锌粒与稀盐酸反应原理书写方程式;
(2)根据碱石灰的成分和其中物质的性质分析解答;
(3)依据反应物、生成物和反应条件书写方程式;
(4)根据检查装置气密性的方法和题目要求分析解答;
(5)根据装置特点和氢化钙与水反应生成氢气进行分析;
(6)氢气的体积等于反应前后液面差;
(7)依据氢气的质量=氢气的体积×氢气的密度求出氢气的质量,再结合氢化钙与水反应方程式及钙与水反应方程式,求出氢化钙的质量,进而计算样品中氢化钙的纯度.
解答 解:(1)锌粒与稀盐酸反应生成氯化锌和氢气,反应的方程式是:Zn+2HCl=ZnCl2+H2↑;
(2)碱石灰是氧化钙和氢氧化钠的混合物,氧化钙与水可反应,氢氧化钠可作干燥剂,且与盐酸能反应,所以该装置的作用是吸收水蒸气和部分氯化氢气体;
(3)钙和氢气在加热的条件下生成氢化钙,方程式是Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2;
(4)要检查该套装置的气密性,可以将活塞关闭后,往分液漏斗中加入适量的水,然后用手指堵住装置D的导管口,打开活塞,观察分液漏斗内的液面变化判断装置是否漏气;
(5)由于氢化钙与水反应生成氢气,所以判断样品与水是否完全反应,可以观察右边的量气管中液面,若不再变化,则已完全反应;
(6)氢气的体积等于反应前后液面差,为:110.0mL-10.0mL=100.0mL;
故答案为:100.0;
(7)反应生成氢气的质量是:100.0mL×0.09mg/mL=9mg
设样品中氢化钙的质量是X,生成氢气质量为Y,则钙的质量为100mg-X,钙与水反应生成氢气质量为9mg-Y则
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
X Y
$\frac{42}{X}$=$\frac{4}{Y}$
Y=$\frac{2X}{21}$
Ca+2H2O═Ca(OH)2+H2↑
40 2
100mg-X 9mg-Y
$\frac{40}{100mg-X}$=$\frac{2}{9mg-Y}$
将Y=$\frac{2X}{21}$代入,解得X=88.4mg
所以样品中氢化钙的纯度为:$\frac{88.4mg}{100mg}$×100%=88.4%;
故答案为:(1)Zn+2HCl=ZnCl2+H2↑;
(2)吸收水蒸气和部分氯化氢气体;
(3)Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2;
(4)将活塞关闭后,往分液漏斗中加入适量的水,用手指堵住装置D的导管口,打开活塞,若气密性良好,可观察到分液漏斗内的液面几乎不下降;
(5)量气管中液面不再变化;
(6)100.0;
(7)88.4%.
点评 本题考查内容全面而综合,解答时要根据相关知识细心分析解答,尤其是计算题,能很好的考查学生对知识的掌握和应用能力.


科目:初中化学 来源: 题型:解答题
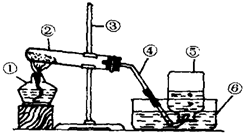 右图是用氯酸钾和二氧化锰制取氧气的实验装置,请回答:
右图是用氯酸钾和二氧化锰制取氧气的实验装置,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 分析下列做法对实验产生的影响.(假定实验中其他操作均正确)
分析下列做法对实验产生的影响.(假定实验中其他操作均正确)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com