

| ||
| 80 |
| x |
| 18 |
| 1.8g |
| 64 |
| 64+16 |
| 10.0g-8.0g+6.4g |
| 10.0g |


 53随堂测系列答案
53随堂测系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
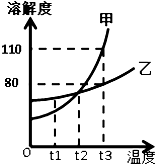 如图所示是甲、乙两固体物质的溶解度曲线,请回答下列问题
如图所示是甲、乙两固体物质的溶解度曲线,请回答下列问题查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
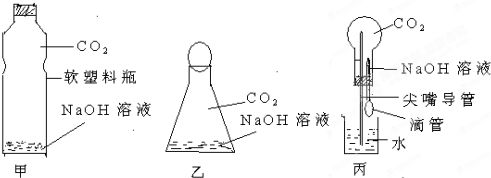
查看答案和解析>>
科目:初中化学 来源: 题型:
如图所示,甲、乙两位同学用如下实验装置测定铜和氧化铜混合物中铜元素的含量,试回答下列有关问题:
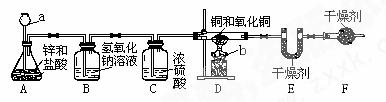
(1)仪器a、b的名称为:a____ b____
(2)A中可观察到的现象为: ![]() ,反应的化学方程式为:____ .。
,反应的化学方程式为:____ .。
(3)C装置的作用为: .。
(4)测定方法:同学甲称量反应前后D装置中玻璃管及其固体物质的质量,同学乙称量反应前后E装置的质量验证同学甲的测定结果。已知D装置中铜和氧化铜混合物的质量为10g,经称量,反应前后E装置的质量分别为100.2g和102.0g,则同学乙测定的原混合物中![]() 铜元素的质量分数为 (假设各装置中的反应或吸收都是完全的)
铜元素的质量分数为 (假设各装置中的反应或吸收都是完全的)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com