
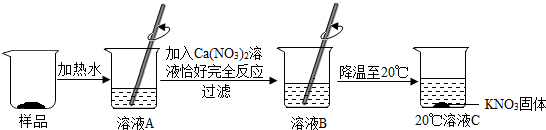
分析 (1)根据Ca(NO3)2溶液与溶液中K2CO3恰好完全反应,生成CaCO3沉淀和KNO3进行解答;
(2)KNO3的溶解度随温度的降低而降低;
解答 解:(1)Ca(NO3)2溶液与溶液中K2CO3恰好完全反应,生成CaCO3沉淀和KNO3,该反应的化学方程式:Ca(NO3)2+K2CO3=CaCO3↓+2KNO3;
(2)由图示可知,降低温度硝酸钾析出,说明KNO3的溶解度随温度的降低而降低;
答案:(1)Ca(NO3)2+K2CO3═CaCO3+2KNO3,(2)下降.
点评 主要考查了固体溶解度的概念、固体溶解度和其饱和溶液中溶质的质量分数及固体溶解度曲线所表示的意义,以此培养学生的分析能力和解决问题的能力.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用酒精浸泡捣烂的某些植物的花瓣制酸碱指示剂 | |
| B. | 水变油 | |
| C. | 用柠檬酸、果汁、白糖、水、小苏打等制汽水 | |
| D. | 用碎鸡蛋壳和醋精(只要成分是醋酸)制二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | PM2.5易导致人体呼吸系统疾病 | |
| B. | PM2.5在空气中不受重力作用 | |
| C. | 若PM2.5进入人体的肺静脉,则其在心脏的四个腔直径会最先进入左心房 | |
| D. | 工业废气处理后再排放对PM2.5的治理能起到积极作用 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 教科书循环使用 | B. | QQ长时间挂机 | C. | 教室无人要关灯 | D. | 出行乘坐公交车 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 样品中只含有NaHCO3 | B. | 样品中一定混有NaHCO3,可能有KCl | ||
| C. | 样品中有NaHCO3,也有Ba(NO3)2 | D. | 样品中混有KCl,也有NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com