同学们在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.
[提出问题]盛放NaOH溶液的试剂瓶瓶口的白色粉末究竟是什么物质?
[查阅资料](1)已知玻璃的主要成分是二氧化硅(Si0
2),它具能与CO
2、SO
2相似的化学性质,与氢氧化钠反应产生的硅酸钠(Na
2SiO
3)和水,硅酸钠也是一种白色固体,俗称“水玻璃”,它是一种凝胶,能将玻璃粘结在一起;
(2)硅酸钠和盐酸或硫酸能发生复分解反应,产生的硅酸(H
2SiO
3)是一种白色难溶解于水的固体.
[成分分析]同学们依据所学的化学知识结合从资料中获取的信息,对这种白色粉末的成分作了如下猜想:
①小军可能是Na
2CO
3和Na
2SiO
3的混合物;
②小红可能是NaOH、Na
2CO
3和Na
2SiO
3的混合物.
[实验验证]为了验证猜想,小红同学取少量上述白色粉末并完全溶于水,用pH试纸测得溶液的pH大于7,继续向溶液中滴加稀盐酸至过量,发现有气体生成,同时还有白色沉淀出现.由此小红认为自己的猜想成立.
(1)写出下列有关化学反应的化学方程式:
①二氧化硅(Si0
2)和氢氧化钠溶液的反应
;
②小红的实验中,白色沉淀形成的化学反应
.
[问题解答]
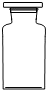
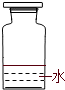
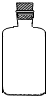
(2)实验室里不同化学试剂的保存方法不尽相同.现有①NaOH溶液、②硝酸银溶液、③大理石、④白磷、⑤稀硫酸等5种药品可分别保存在下列各试剂瓶中,请把NaOH溶液和硝酸银溶液的序号填写在各试剂瓶下面的括号内:
| A |
B |
C |
D |
E |
 |
 |
 |
 |
 |
| ( ) |
( ) |
( ) |
( ) |
( ) |
(3)老师和同学们都认为小红所得结论不正确,为什么?
.
[含量测定]在老师的指导下,同学们设计了实验并通过实验证明小军的猜想成立.为进一步确定白色粉末中碳酸钠的质量分数,他们设计了如下2种不同的实验方案:
方案一:气体分析法--取2.5g白色粉末样品,放入锥形瓶(见下图),加入足量的盐酸充分反应,气体最后通入氢氧化钠溶液(假设气体全部被氢氧化钠吸收,忽略系统内空气中CO
2的影响),两次称量盛氢氧化钠溶液的洗气瓶的质量,得前后两次质量差为0.90g.
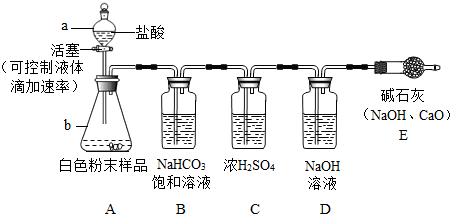
[实验讨论]
①向锥形瓶加入白色粉末样品前,必须进行的操作是
;
②装置E的作用是
;
③用B中NaHCO
3饱和溶液除去CO
2中混有的少量HCl气体,B中的NaHCO
3溶液能否换成石灰水?请判断并写出理由
.
④老师和同学们都认为:不能根据以上实验数据0.90g计算白色粉末中碳酸钠的质量分数,理由是
;
⑤为达到准确测定白色粉末样品中碳酸钠的质量分数的目的,应该加以改进,你认为改进方法是
.
方案二:沉淀分析法--另取一定量白色粉末的样品,按照下图所示的过程进行实验,测定产生的硅酸的质量以推算碳酸钠的质量分数.
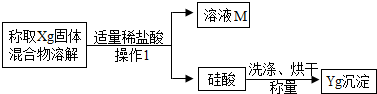
(1)“操作1”的名称是
_;
(2)确定盐酸是否适量的方法是
(说明实验的操作、现象与结论);
(3)若实验中所取样品的质量为3g,产生硅酸沉淀的质量为0.39g.计算该白色粉末中碳酸钠的质量分数.
[反思评价]导致测定的结果偏大的原因可能是
.

 用所学化学知识解决下列问题:
用所学化学知识解决下列问题:





