王明同学为测定某石灰石中碳酸钙的质量分数(杂质不与酸反应),向6.0g石灰石样品中逐滴加入稀盐酸至不再产生气泡为止,共生成二氧化碳气体2.2g.试计算:
(1)碳酸钙中钙元素的质量分数是多少?______
(2)该石灰石样品中碳酸钙的质量分数为多少?(写出计算过程,结果精确至0.1%)
(3)若要计算上述反应所消耗盐酸溶液的质量,题中还缺少的一个数据是.______.
【答案】
分析:(1)利用化学式中元素的质量分数等于该元素的原子量之和与其相对分子质量之比求解即可;
(2)利用碳酸钙与盐酸反应的化学方程式,根据二氧化碳的质量求出碳酸钙的质量,再根据

×100%求出石灰石样品中碳酸钙的质量分数.
(3)根据溶液中溶质的质量分数=

×100%这个公式进行分析.
解答:解:(1)由化学式中某元素的质量分数等于该元素的原子量之和与其相对分子质量之比可知:碳酸钙中钙元素的质量分数=
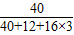
×100%=40%;
(2)设6.0g石灰石样品中CaCO
3的质量为x.
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
100 44
x 2.2g

x=5.0g
石灰石样品中碳酸钙的质量分数为
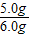
×100%=83.3%
答:石灰石样品中碳酸钙的质量分数为83.3%
(3)要求盐酸溶液的质量,必须知道盐酸溶液溶质的质量分数和溶质的质量,而溶质的质量可根据化学方程式计算出,还需要知道盐酸溶液中溶质的质量分数即可.
故答案为:(1)40%(2)83.3%(3)盐酸的溶质质量分数
点评:本题主要考查根据化学方程式的计算,难度较小.石灰石为混合物,石灰石中除了碳酸钙之外还有杂质,不能将石灰石的质量直接代入化学方程式进行计算.

 ×100%求出石灰石样品中碳酸钙的质量分数.
×100%求出石灰石样品中碳酸钙的质量分数. ×100%这个公式进行分析.
×100%这个公式进行分析.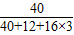 ×100%=40%;
×100%=40%;
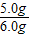 ×100%=83.3%
×100%=83.3%
