
分析 (1)根据黄铜的成分铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,根据密度公式计算氢气的体积.
(2)据此根据反应的化学方程式列式计算出参加反应锌的质量,进而计算出铜的质量和铜的质量分数.
(3)根据每24份质量的镁会与73份质量的盐酸反应生成2份质量的氢气,镁54份质量的铝和219份质量的盐酸反应生成6份质量的氢气,每65份质量锌和73份质量的盐酸反应生成2份质量的氢气,结合题中的选项进行分析.
解答 解:(1)根据质量守恒定律,产生氢气的质量为:10g+40g-49.9g=0.1g;体积为$\frac{0.1g}{0.09g/L}$=1.11L;
(2)设黄铜样品中锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.1g
$\frac{65}{x}=\frac{2}{0.1g}$
x=3.25g
黄铜样品中铜的质量分数为:$\frac{10g-3.25g}{10g}$×100%=67.5%
每24份质量的镁会与73份质量的盐酸反应生成2份质量的氢气,镁54份质量的铝和219份质量的盐酸反应生成6份质量的氢气,每65份质量锌和73份质量的盐酸反应生成2份质量的氢气,假设金属的质量都是24g,等质量的金属消耗盐酸的质量分别是:
Mg+2HCl=MgCl2+H2↑,
24 73
24g 73g
2Al+6HCl=2AlCl3+3H2↑
54 219
24g 97.3g
Zn+2HCl=ZnCl2+H2↑
65 73
24g 27g
令三种金属质量均为24g,则
当盐酸质量m>73g时,生成氢气的质量:Al>Mg>Zn;
当盐酸质量27g<m≤73g时,生成氢气质量:Al=Mg>Zn;
当盐酸质量m≤27g时,生成氢气质量:Al=Mg=Zn
所以,②③④这3个猜测合理,即答案选C
答案:(1)0.1g;1.11L;(2)黄铜样品中铜的质量分数为67.5%.(3)C.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:初中化学 来源: 题型:实验探究题
| 金属 | 导电性(100为标准) | 密度(g/cm3) | 熔点(℃) |
| A | 99 | 8.92 | 1083 |
| B | 61 | 2.70 | 660 |
| C | 17 | 7.86 | 1535 |
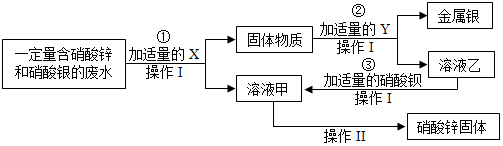
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
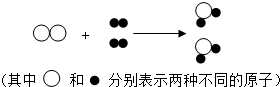 如图,表示在一定条件下发生的某化学反应,则下列说法正确的是( )
如图,表示在一定条件下发生的某化学反应,则下列说法正确的是( )| A. | 两种反应物均为化合物 | B. | 该反应不符合质量守恒定律 | ||
| C. | 该反应前后元素的种类发生了改变 | D. | 该反应属于化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Al | B. | Fe | C. | Fe2O3 | D. | Al2O3 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
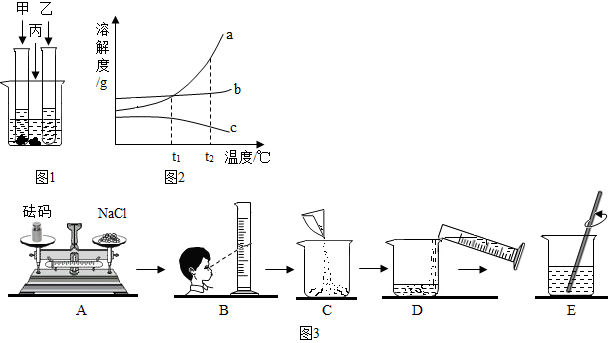
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④⑧ | B. | ②⑥⑦⑨ | C. | ①③⑦ | D. | ④⑤⑥⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com