
分析 根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式.
解答 解:(1)铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)“洁厕灵”中含有稀盐酸,能和氢氧化钠反应生成氯化钠和水,能和铝反应生成氯化铝和氢气,反应的化学方程式为:NaOH+HCl=NaCl+H2O,2Al+6HCl=2AlCl3+3H2↑.
故填:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;NaOH+HCl=NaCl+H2O,2Al+6HCl=2AlCl3+3H2↑.
点评 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.


 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
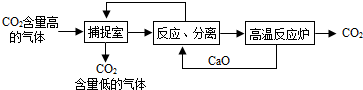
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 除去NaOH溶液中的Na2CO3,加入过量石灰水 | |
| B. | 鉴别稀盐酸和石灰水,分别滴加Na2CO3溶液 | |
| C. | 检验NaOH溶液是否显碱性,滴加酚酞溶液 | |
| D. | 分离CO和CO2,将混合气体通过足量NaOH溶液,再向所得溶液中加足量稀硫酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
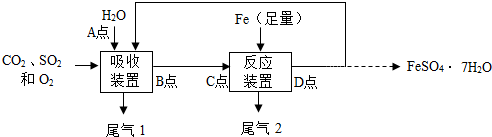
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com