
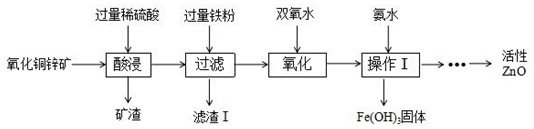
分析 (1)在氧化铜锌矿中加入过量稀硫酸,稀硫酸和氧化铜反应生成硫酸铜和水,和氧化锌反应生成硫酸锌和水;
(2)加过量铁粉后,铁和稀硫酸反应生成硫酸亚铁和氢气,和硫酸铜反应生成氯化亚铁和铜,都属于置换反应;
(3)过氧化氢氧化亚铁离子后被还原成水.
解答 解:(1)在氧化铜锌矿中加入过量稀硫酸,稀硫酸和氧化铜反应生成硫酸铜和水,和氧化锌反应生成硫酸锌和水,反应的化学方程式为:CuO+H2SO4═CuSO4+H2O,ZnO+H2SO4═ZnSO4+H2O.
故填:CuO+H2SO4═CuSO4+H2O;ZnO+H2SO4═ZnSO4+H2O.
(2)加过量铁粉后,铁和稀硫酸反应生成硫酸亚铁和氢气,和硫酸铜反应生成氯化亚铁和铜,发生反应的基本反应类型是置换反应,得到滤渣1的成分是反应生成的铜和过量的铁.
故填:置换反应;Cu、Fe.
(3)在实验过程中,选用双氧水的优点是过氧化氢被还原成水,不带入新的杂质.
故填:过氧化氢被还原成水,不带入新的杂质.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:选择题

| A. | 甲、乙两种物质均属于可溶物质 | |
| B. | 40℃时,质量分数均为25%的甲、乙两物质的溶液降温到20℃,甲析出晶体,乙不析出晶体 | |
| C. | 40℃时,将等质量的甲、乙两物质的饱和溶液,分别降温至20℃,所得溶液中溶质的质量甲小于乙 | |
| D. | 将40℃时75g甲物质的饱和溶液降温到20℃,溶液的质量变为55g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 为了测定某不纯锌粉样品中锌的质量分数(杂质不溶于水,也不与其他物质反应),某化学小组进行了如下实验,请计算:
为了测定某不纯锌粉样品中锌的质量分数(杂质不溶于水,也不与其他物质反应),某化学小组进行了如下实验,请计算:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | SO2+H2O═H2SO3 | B. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ | ||
| C. | 2Al+3CuSO4═Al2(SO4)3+3Cu | D. | Fe2O3+3H2SO4=Fe2(SO4)3+3H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一氧化碳有还原性,可用作冶炼金属 | |
| B. | 石墨具有导电性,可用作电极 | |
| C. | 纯碱可用作炉具清洁剂 | |
| D. | 熟石灰可用于中和酸性土壤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com