
| | 实验目的 | 实验方案 |
| A | 探究燃烧所有条件 | 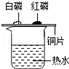 . . |
| B | 探究铁生锈所有条件 | 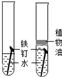 |
| C | 探究MnO2对过氧化氢溶液 分解速度的影响 | 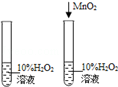 |
| D | 实验室制取二氧化碳的药品研究 | 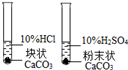 |
科目:初中化学 来源:不详 题型:实验题

| 实验编号 | 实验操作 | 实验现象 |
| ① | 取黑色粉末加足量稀硫酸 | 固体部分溶解,有气泡产生,溶液无蓝色 |
| ② | 取实验①的残渣灼烧,将内壁涂 有澄清石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 | |
| 实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | 氯酸钾 | 580 |
| ② | 氯酸钾、二氧化锰(质量比1:1) | 350 |
| ③ | 氯酸钾、氧化铜(质量比l:1) | 370 |
| ④ | 氯酸钾、氧化铁(质量比1:1) | 390 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验步骤 | 实验现象 | 结论 |
| 1.在试管中加入适量过氧化钠,再加入足量水; | 1.黄色粉末溶解,有 产生 | 产物 (填“有”或“没有”)氧气; |
| 2.用 伸入试管 | 2.木条复燃 | |
| ③再向试管中加入几滴酚酞试液. | | 产物有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 金属 | Ti | Al | Cu |
| 与盐酸反应现象 | 反应缓慢 | 反应剧烈 | 无明显现象 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题


查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象 | 结论 |
| 取白色沉淀甲,滴加足量的稀硝酸 | 沉淀部分消失 | 白色沉淀甲中一定含有 |
| 实验操作 | 实验现象 | 结论 | |
| 实验Ⅰ | 取适量无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含 |
| 实验Ⅱ | 步骤①:取适量无色滤液乙,加入过量的 溶液,过滤 | 生成白色沉淀 | 原白色固体样品中一定存在该物质 |
| 步骤②:取步骤①中的滤液,滴加 溶液 | | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com