【答案】
分析:[问题讨论](1)溶液中Fe
3+呈黄色,氧化铁和氢氧化铁都能和硫酸反应,生成Fe
3+;
(2)若为铜,则是铜在加热时与空气中的氧气反应;加热质量不变,说明是氧化铁;
应用之一:(1)主要有三个反应,氢氧化铁和盐酸反应、三氯化铁和氢氧化钠反应、氢氧化铁的加热分解;
(2)固体和溶液分离,要采用过滤操作;
(3)若纯度不高,由元素守恒,可能有损失的铁,则原因可能为红褐色固体加热不充分或操作a得到的溶液X不澄清等;
应用之二:(1)A中反应产物有二氧化碳、一氧化碳、水,在D中要CO还原氧化铁,并进行成分计算,所以要排除A中产生的二氧化碳和水;
(2)为确保氧化铁被完全反应,CO过量,有毒不能排放在空气中,要增添尾气处理装置;
(3)CO不纯,点燃可能会引起爆炸,应让CO充满整个装置,所以要先让A中反应发生,结束时为防止铁被氧化,要继续通一会CO,所以要先停止D加热;
(4)装置与外界空气相通,氢氧化钠溶液易吸收空气中CO
2;
(5)样品中氧化铁的质量可由表中甲组数据计算;铁红的纯度用氧化铁质量和样品质量来求.
解答:解:[问题讨论](1)因为氢氧化铁和氧化铁都能和硫酸反应,形成黄色的硫酸铁溶液;
(2)铜能与氧气加热反应,而氧化铁不反应,化学方程式:2Cu+O
2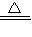
2CuO;加热质量不变,说明没有铜,故乙同学的猜想正确;
应用之一:(1)氢氧化铁和盐酸反应的化学方程式:Fe(OH)
3+3HCl=FeCl
3+3H
2O
(2)因为固体和液体分离要用过滤操作,故答案为:漏斗
(3)纯度不高,说明铁没有完全转化到最终产物,可能是氧化铁加热不充分,或操作a得到的溶液X不澄清等;
应用之二:(1)A中反应产物有二氧化碳、一氧化碳、水,要净化、除杂,故装置的作用是除去一氧化碳中含有的二氧化碳、干燥一氧化碳
(2)CO有毒,过量气体不能排放在空气中,应在装置E后增添尾气处理装置(在装置E后或放一盏燃着的酒精灯;或在装置E后连接排水法收集气体的装置;或在装置E后套上气球或气囊)
(3)CO不纯,点燃可能会引起爆炸,还原结束要防止铁被氧化,所以要先产生一氧化碳,反应后还要继续通入一氧化碳至装置冷却;
(4)空气中的二氧化碳也一起被E中溶液吸收,所以会造成结果偏大;
(5)可依据化学方程式,利用量差法进行计算.写出方程并列出相应的已、未知量,得出答案.设样品中氧化铁的故答案为:
【问题讨论】(1)氢氧化铁也能和硫酸反应,形成黄色溶液(2)2Cu+O
2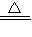
2CuO 乙
之一:(1)Fe(OH)
3+3HCl=FeCl
3+3H
2O(2)漏斗(3)红褐色固体加热不充分(或操作a得到的溶液X不澄清等.只要合理即可)
应用之二:(1)除去一氧化碳中含有的二氧化碳、干燥一氧化碳(2)在装置E后增添尾
气处理装置(在装置E后或放一盏燃着的酒精灯;或在装置E后连接排水法收集气体的装置;或
在装置E后套上气球或气囊)(3)A、先(4)装置E中的氢氧化钠溶液吸收了空气中的
二氧化碳(每空均1分)
(5)质量为X,由表中甲组数据
Fe
2O
3~3O
160 48
X (60-57.6)g
160:48=X:(60-57.6)g
解得:X=8g
纯度为:
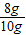
×100%=80%
答:其纯度为80%
点评:此题综合性很强,要根据物质的性质和题目要求,结合相应的实验操作进行解答,亚铁离子在溶液中是浅绿色的,铁离子在溶液中呈现黄色.

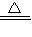 2CuO;加热质量不变,说明没有铜,故乙同学的猜想正确;
2CuO;加热质量不变,说明没有铜,故乙同学的猜想正确;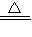 2CuO 乙
2CuO 乙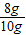 ×100%=80%
×100%=80%

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案