CO
2 变大 < 高锰酸钾 a 气密 不要 a 不符合 解:设甲醛的质量为x
4KMnO
4 +5CH
2O+6H
2SO
4 =4MnSO
4+2K
2SO
4+5CO
2↑+11H
2O
4×158 5×30
5.00g×1.58×10
-4x
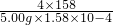
=
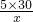
x=1.875×10
-4因为每次用注射器抽取100mL室内空气,第250次恰好反应,则通入的空气体积为:100ml×250=25000mL=25L,所以该居室内空气中甲醛的含量
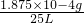
=0.0075mg/L=7.5×10
-3mg/L>8×10
-5mg/L,故不符合 25 没有搅拌,甲醛和高锰酸钾反应不完全 空气中的其它气体和高锰酸钾反应 增大了甲醛和溶液的接触面积
分析:①根据化学反应前后原子的种类和个数都不变,分析X的化学式;
②根据反应过程中硫酸逐渐参加反应分析溶液PH的变化;根据配制混和液时使用了过量的硫酸,因此溶液呈现酸性,判断pH;
③根据信息甲醛与混和液中的KMnO
4恰好完全反应,可依据化学方程式中高锰酸钾的质量计算甲醛的质量分析;
④根据检查该装置气密性时要注意形成一个密闭的空间分析开关的闭合情况;
⑤根据向集气瓶中加入5.00g 混和液,需要向其中加适量蒸馏水,扩大液体的量以利吸收甲醛分析蒸馏水的处理;
⑦根据吸取室内的气体需要通过a开关,而将气体推进溶液中需要通过b开关分析;
⑧根据高锰酸钾的质量计算甲醛的质量,然后计算空气中甲醛的含量和标准进行比较得出结论;
⑨根据导气管和溶液局部接触,反应不充分或从空气的气体气体可能和高锰酸钾反应等进行猜想;
⑩根据导气管和多孔的球泡的不同处分析优点.
解答:①根据质量守恒定律化学反应前后原子的种类和个数都不变,反应前后K原子的个数都是4个,Mn的原子个数是4个,S原子的个数是6个,H原子的个数是22个,而反应前C原子的个数是5个,O原子的个数是45个,而反应后没有C原子,35个O原子,故缺少5个C原子,10个O原子,X的化学式前的化学计量数是5,所以X的化学式是CO
2;故答案为:CO
2;
②混合液中含有硫酸,反应过程中硫酸逐渐参加反应,因此溶液的酸性会减弱,则pH会变大;因为配制混和液时使用了过量的硫酸,因此反应结束时溶液呈现酸性,故pH会小于7;故答案为:变大;<;
③根据信息甲醛与混和液中的KMnO
4恰好完全反应,因此可依据化学方程式中高锰酸钾的质量计算甲醛的质量,而高锰酸钾的质量=混合液的质量×高锰酸钾的质量分数;故答案为:高锰酸钾;
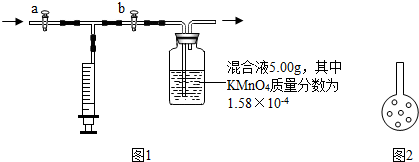
④检查该装置气密性时要注意形成一个密闭的空间,因此在抽或推注射器前要先关闭开关a,防止空气进入集气瓶内;因为通过抽或推注射器,使装置内的气压变小或变大,从而造成左导管与瓶内产生液面差且液面差稳定,所以装置的气密性良好;故答案为:a;气密;
⑤因为向集气瓶中加入5.00g 混和液,需要向其中加适量蒸馏水,扩大液体的量以利吸收甲醛,因此原有的蒸馏水可以不要倒走;故答案为:不要;
⑦吸取室内的气体需要通过a开关,而将气体推进溶液中需要通过b开关,因此要用注射器取空气药品时,要先打开a,关闭b;故答案为:a;
⑧根据高锰酸钾的质量计算甲醛的质量,然后计算空气中甲醛的含量和标准进行比较得出结论;
故解:设甲醛的质量为x
4KMnO
4 +5CH
2O+6H
2SO
4 =4MnSO
4+2K
2SO
4+5CO
2↑+11H
2O
4×158 5×30
5.00g×1.58×10
-4 x
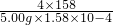
=
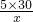
x=1.875×10
-4因为每次用注射器抽取100mL室内空气,第250次恰好反应,则通入的空气体积为:100ml×250=25000mL=25L,所以该居室内空气中甲醛的含量
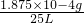
=0.0075mg/L=7.5×10
-3mg/L>8×10
-5mg/L,故不符合;
⑨用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,可能是没有搅拌,甲醛和高锰酸钾反应不完全;空气中的其它气体和高锰酸钾反应;故答案为:没有搅拌,甲醛和高锰酸钾反应不完全;空气中的其它气体和高锰酸钾反应;
⑩导气管的面积较小,会使反应不充分,而多孔的球泡能够增大反应物的接触面积;
故答案为:增大了甲醛和溶液的接触面积.
点评:本题是有关室内甲醛含量的测定的探究,涉及的知识点较多:质量守恒定律的运用、溶液pH的变化、装置气密性的检查、取用样品的方法、根据化学方程式的计算、装的评价等,综合性较强,难度较大.

 =
=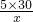 x=1.875×10-4
x=1.875×10-4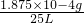 =0.0075mg/L=7.5×10-3mg/L>8×10-5mg/L,故不符合 25 没有搅拌,甲醛和高锰酸钾反应不完全 空气中的其它气体和高锰酸钾反应 增大了甲醛和溶液的接触面积
=0.0075mg/L=7.5×10-3mg/L>8×10-5mg/L,故不符合 25 没有搅拌,甲醛和高锰酸钾反应不完全 空气中的其它气体和高锰酸钾反应 增大了甲醛和溶液的接触面积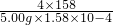 =
=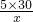 x=1.875×10-4
x=1.875×10-4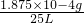 =0.0075mg/L=7.5×10-3mg/L>8×10-5mg/L,故不符合;
=0.0075mg/L=7.5×10-3mg/L>8×10-5mg/L,故不符合;
