某种钾肥样品,其成分为碳酸钾、氯化钾和少量不含钾元素的难容杂质.为测定该钾肥样品中钾元素的含量,进行如下实验:①称取10g该样品溶于水,过滤出去难容杂质,得到滤液;②在说得滤液中逐滴加入溶质质量分数为10%的稀盐酸,至恰好完全反应时测得所消耗的稀盐酸质量为36.5g;③将反应后的溶液蒸干,称得所得白色固体为10.2g.
请你根据实验数据计算:
(1)样品中碳酸钾的质量;
(2)样品中钾元素的质量分数;
(3)用pH试纸测定第②步反应后溶液的pH,结果溶液pH大于7,你认为上述实验测得样品中钾元素的质量分数比实际值______(填“大”、“小”或“不变”)理由是______.
【答案】
分析:(1)氯化钾不与稀盐酸反应,碳酸钾与稀盐酸反应生成氯化钾、水和二氧化碳,由恰好完全反应时所消耗盐酸的质量,计算出参加反应的碳酸钾的质量;
(2)恰好完全反应后所得溶液为氯化钾溶液,溶液蒸干后所得白色固体为氯化钾,其中钾元素的质量即样品中钾元素质量,利用该质量与样品的质量比求得样品中钾元素的质量分数;
(3)反应后溶液的pH大于7,可判断碳酸钾并未完全反应;根据碳酸钾与盐酸反应的化学方程式,分析碳酸钾与氯化钾的质量关系,判断溶液蒸干所得白色固体质量的偏差,从而判断以上计算样品中钾元素的质量分数的偏差.
解答:解:(1)设碳酸钾质量为x
K
2CO
3+2HCl═2KCl+H
2O+CO
2↑
138 73
x 36.5×10%
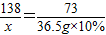
x=6.9g
答:样品中碳酸钾的质量为6.9g;
(2)钾元素的质量分数=

=53.4%;
答:样品中钾元素的质量分数为53.4%;
(3)根据反应的化学方程式K
2CO
3+2HCl═2KCl+H
2O+CO
2↑,可得知反应中碳酸钾与氯化钾的质量比=138:149,即碳酸钾反应生成氯化钾后固体质量增加;而题中在反应后测定溶液的pH大于7,说明碳酸钾并未完全反应,则溶液蒸干所得白色固体质量会偏小,使得所计算的样品中钾元素质量也偏小;
故答案为:小;蒸干后得到的固体中含有碳酸钾,使白色固体质量偏小.
点评:本题因涉及实验的误差分析而使问题的难度大大增加,误差分析时,利用反应的化学方程式中物质的质量比对是否完全反应对反应后溶质质量的影响进行判断.

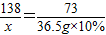
 =53.4%;
=53.4%;