
【题目】CaSO4固体受热时可分解为CaO,其化学方程式为 a CaSO4![]() bCaO+ cSO2↑+dX↑。取2.72 g CaSO4充分加热,使之完全分解。将产生的气体通过碱石灰(CaO和NaOH的的固体混合物),碱石灰增重1.28g;再通过灼热的铜网,铜网增重0.32g。则下列说法正确的是
bCaO+ cSO2↑+dX↑。取2.72 g CaSO4充分加热,使之完全分解。将产生的气体通过碱石灰(CaO和NaOH的的固体混合物),碱石灰增重1.28g;再通过灼热的铜网,铜网增重0.32g。则下列说法正确的是
A. 剩余固体的质量为1.44g B. SO2的质量为1.6g C. X化学式可能是SO3 D. 方程式中a:c=1:1
【答案】D
【解析】A、根据质量守恒定律可知,剩余固体的质量为2.72g-1.28g-0.32g=1.12g,错误;
B、碱石灰增重1.28g,增加的是二氧化硫的质量,SO2的质量为1.28g,错误;
C、2.72 g CaSO4中硫元素的质量=2.72g×![]() ×100%=0.64g,1.28g SO2 中硫元素的质量=1.28g×
×100%=0.64g,1.28g SO2 中硫元素的质量=1.28g×![]() ×100%=0.64g,根据质量守恒定律元素的质量在化学反应前后质量不变,X中不可能存在硫元素,X不可能是SO3,错误;
×100%=0.64g,根据质量守恒定律元素的质量在化学反应前后质量不变,X中不可能存在硫元素,X不可能是SO3,错误;
D、根据反应的方程式可知,反应中CaSO4和SO2的质量比为:126a:64c=2.72g:1.28g,可得a:c=1:1,正确。故选D。


科目:初中化学 来源: 题型:
【题目】某同学逛超市时发现食品添加剂中有“碳酸氢铵”,感觉很惊讶,“碳酸氢铵”是臭粉啊,怎么可以放进食品?于是开展了以下探究,请你帮助完成下列相关问题。
(1)查阅资料:
①食用级碳酸氢铵比较纯净,可作膨松剂,一般用在油炸食品中,水蒸食品中不用;
②常温常压下,1体积水约能溶解600体积氨气,其水溶液呈弱碱性。
③碱石灰是氧化钙和氢氧化钠的混合物。
(2)产生疑惑:臭粉为何可以作膨松剂?为何一般适用于油炸食品而不适用于水蒸食品?(3)实验设计:实验装置如图,图一是检验装置,图二是收集装置,取适量碳酸氢铵分置于两试管中,按如图进行实验。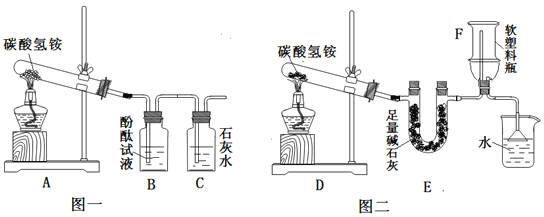
(4)现象与分析:
①图一:B中现象是__________,C中发生反应的化学方程式是_______________。
②图三:装置E的作用是_________,用F装置收集氨气,说明氨气具有_________性质,取下F,塞紧橡皮塞,用注射器向F中注入少量水,震荡,可看到的现象是______,拔出橡皮塞闻到氨味。
(5)解释与结论:①有臭味的碳酸氢铵添加到食品中,如果油炸,则含有的少量碳酸氢铵受热时完全分解,产生的气体使食品膨胀,且生成物可以迅速挥发而离开食品,没有残留物,其臭味会消失,碳酸氢铵受热发生反应的化学方程式是__________
②添加碳酸氢铵的食品如果水蒸,则__________。
通过上述探究该明白了:高纯度的碳酸氢铵可以作为食品添加剂,但同一食品添加剂并不适合所有食品,使用食品添加剂需严格控制用量。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学科学在防治大气污染和水污染方面发挥了重要作用,请结合下列图示回答问题
(1)从源头消除污染。图1是充分燃烧1kg天然气和煤所产生的二氧化碳和二氧化硫的质量,通过比较你认为应选择______填(“煤”或“天然气”)作燃料对环境影响较小
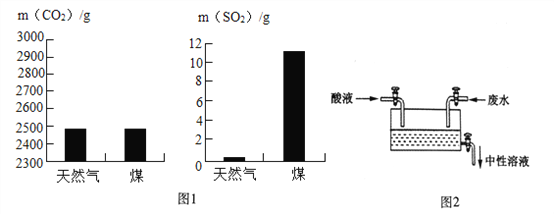
(2)处理气体排放物控制大气污染。火力发电厂需将燃烧产生的二氧化硫进行处理其原理是![]() ___________________(补充完整化学方程式),这样可以减少酸雨的形成。
___________________(补充完整化学方程式),这样可以减少酸雨的形成。
(3)处理液体排放物控制水污染。某造纸厂排放的废水中含有NaOH,可采取中和方法处理达标后再排放。具体做法:在废水流量不变的情况下,分别用溶质质量分数相同的稀硫酸和稀盐酸(两种酸液的密度相同)来处理,通过调节流量阀来控制酸液的流量(Q),使最终排出的溶液呈中性(如图2),则两种酸溶液的流量大小关系是:Q(稀硫酸)________ (“>”、“=”或“<”)Q(稀盐酸)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____________。
【查阅资料】CaC12 滚液显中性
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想I:只有CaC12 猜想II:有__________
猜想III:有CaC12和Ca(OH)2 猜想IV:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是_________________。
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ____________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【得出结论】通过探究,全班同学一致确定猜想III是正确的。
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因____________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】课外小组的同学自制一块多槽铁板,设计了下图所示装置,用以探究燃烧的条件。(说明:金属板上白磷足量)。回答下列问题:
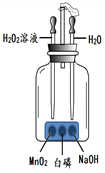
(1)推出可燃物燃烧需要一定温度的依据是__________。
(2)将过氧化氢溶液滴入盛有MnO2 的金属槽中,发生反应的化学方程式为__________。
(3)有同学提出“将NaOH换成水,然后将水换成浓硫酸,也可以完成探究活动”。你认为是否可行,为什么?_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某品牌可乐汽水、白砂糖、焦糖色素(使可乐显黑褐色)、磷酸(H3PO4)等按一定比例混合并压入二氧化碳配制而成。
(1)磷酸中H、P、O三种元素的质量比为_______________。
(2)某同学为了定量测定可乐中磷酸的含量,进行如下实验
步骤1:取可乐样品25mL,加入活性炭,浸泡、过滤、洗涤。
步骤2:将滤液煮沸10min,冷却,加入适量蒸馏水。
步骤3:继续往滤液中加几滴某指示剂,再逐滴滴入0.1%的NaOH溶液20g,恰好完全反应。(测定原理: H3PO4+NaOH=NaH2PO4+H2O)
①步骤1中活性炭的作用是_____________________
②步骤2中“煮沸10min"能除尽滤液中CO2的原因之一是当温度升高时,气体的溶解度_______(填“变大”“变小”或“不变”)。
③计算1L可乐中磷酸的含量_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是某同学对初中所学气体制备等知识进行的整理,请你结合下列装置图,回答有关问题:
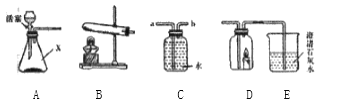
(1)装置A中,仪器X的名称为_______________。
(2)用高锰酸钾在装置B中制取氧气,需要进行的改进是_______________。
(3)写出实验室用装置A制取CO2的化学方程式___________________;若用C装置收集氧气,则气体从___(填“a”或“b”)端通入。
(4)某同学点燃蜡烛,然后放入D中,迅速连接A、D、E,打开活塞,发现E中逐渐变浑浊,则装置A中产生的气体__(填“一定”或“不一定”)为二氧化碳气体,原因是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学活动小组用镁和铁探究金属的反应规律。
【查阅资料】
①镁,铁的活动性均在 H 之前并且镁比铁活泼。
②相同条件下,相同时间内金属的活动性越强,与酸反应越剧烈,产生的氢气越多。
【探究一】在室温条件下进行如图所示实验。试管内的镁带和铁片表面均被打磨洁净,且形 状、大小相同;同时加入等质量和等浓度的稀盐酸。
(1)该兴趣小组的同学认为该方案中长颈漏斗起非常重要的作用。
①通过相同条件下,相同时间内长颈漏斗中 __________
②长颈漏斗在实验中还可以起_________________ 作用。
(2)在甲、乙装置的水中滴入 2~3 滴红墨水的目的_______________。
(3)乙装置中反应方程式为______________,该反应属于基本反应类型中的_______反应。
(4)观察到甲装置中产生气泡速率比乙装置快或 __________现象时,都可以证明镁的金属活动性比铁的强。
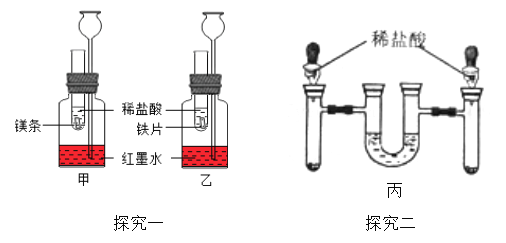
【探究二】方案二:如图丙,将等质量光亮洁净,形状厚薄相同的镁条和铁片分别放入左、 右试管中,加入等质量、等质量分数的稀盐酸,充分反应后,冷却到室温,金属均有剩余,(U 型管内为水,初始液面相平,反应过程中装置气密性良好)。
(5)实验过程中 U 型管中液面 _______(填“左高右低”,“左低右高”,“相平”); 充分反应后,冷却到室温 U 型管中液面 ___________填“左高右低”,“左低右高”,“相平”),原因是_____。
【探究三】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出 的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是 ________。写成发生反应的化学方程式 ________ 。
A.滤出的固体中一定含有铜 B.滤出的固体可能含有铁和镁
C.滤液中可能含有硫酸铜 D.滤液中一定含有硫酸镁和硫酸亚铁
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钠和硝酸钾两种固体的溶解度曲线如右图所示。下列说法正确的是
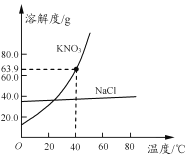
A.硝酸钾的溶解度大于氯化钠的溶解度
B.常用冷却结晶的方法从氯化钠溶液中获得其晶体
C.40℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的溶质质量分数为39.0%
D.将20℃的硝酸钾饱和溶液升温至60℃,溶液的溶质质量分数增大(忽略水分蒸发)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com