
【题目】请从 A 或B 两题中任选一个作答,若两题均作答,按 A 计分。
在一定条件下,Mg 和 MgH2的相互转化可以实现氢气的储存和释放。其工作原理如图。
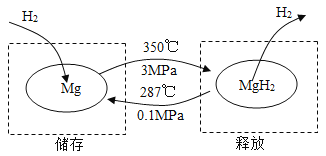
A | B |
(1)氢气储存时发生反应的化学方程式为_______。 (2)氢气很容易逃逸,若氢气存储效率为 10%,储存 1 kg 氢气,至少需要 Mg 的质量为_______ kg。 | (1)氢气释放时发生反应的化学方程式 为_______。 (2)理论上,52 kg MgH2最多能释放氢气的质量为_______ kg。 |
科目:初中化学 来源: 题型:
【题目】水是人类宝贵的自然资源。
(1)天然水中含有许多杂质,实验室常用过滤方法除去水中不溶性杂质,过滤需要用到的仪器有带铁圈的铁架台、烧杯、漏斗和 (填仪器名称)。
(2)硬水给生活和生产带来很多麻烦,生活中常用 的方法降低水的硬度。
(3)氯气可用作自来水的消毒剂,实验室制取氯气的化学方程式为:
MnO2+4HCl(浓)![]() X+Cl2↑+2H2O,X的化学式为 。
X+Cl2↑+2H2O,X的化学式为 。
(4)在电解水的实验中,两电极相连的玻璃管上方产生的气体是氧气和氢气,一段时间后,氧气和氢气的体积比约为 。
(5)甲和乙两种固体物质的溶解度曲线如图所示。
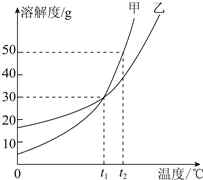
①t1℃时,甲和乙的溶解度 (填“相等”或“不相等”)。
②t2℃时,甲和乙的饱和溶液各100g,两种溶液中溶剂的质量大小关系为:甲 乙(填“>”、“=”或“<”)。
③将t2℃时150g甲的饱和溶液降温至t1℃,所得溶液中溶质的质量分数为 (计算结果精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种物质的溶解度曲线。下列判断不正确的是
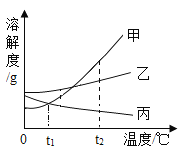
A.t2℃丙的饱和溶液温度降低变为不饱和溶液
B.三种物质中,溶解度随温度变化最明显的是甲
C.t2℃甲的饱和溶液温度降低,溶质的质量分数减小
D.甲和乙的饱和溶液分别由t2℃降到t1℃,乙析出晶体的质量比甲的多
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜及铜的化合物在生产、生活中有着广泛的应用。
(一)铜的广泛应用
(1)我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理______。
(2)铜在工业上可用于生产电缆(外面包裹了电缆皮),这是利用了铜的_____性。
(二)硫酸铜晶体的制备
工业上用含铜废料(如:碎铜、电缆皮等)。某化学小组的同学提出可以用含铜废料制备硫酸铜晶体(CuSO4·xH2O).主要流程如下:
![]()
(1)含铜废料粉碎的目的是__________。
(2)该流程中,加入H2O2后要求温度控制在50℃到60℃加热的原因为_____。
(3)兴趣小组同学一致指出,将滤液经蒸发浓缩、_____(填结晶方法)、过滤等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体(CuSO4·xH2O),晶体采用酒精淋洗而不用水的原因是____________。
(三)铜生锈会生成碱式碳酸铜,而工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。
资料:xCuCO3·yCu(OH)2·zH2O加热至200时会分解得到氧化铜,二氧化碳和水。
测定某种产品的组成,该兴趣小组准确称量了25.8g的样品,设计了如下装置并进行实验:
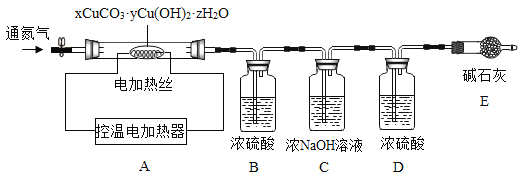
实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | E中固体质量/g | |
反应前 | 100.0 | 100.0 | 100.0 | 120.5 |
反应后 | 105.4 | 104.4 | 100.2 | 120.5 |
实验分析和数据处理
(1)实验前应该先_________,再鼓入一段时间氮气后称量B、C、D、E的质量。
(2)停止鼓入氮气,调控温电加热220℃持续加热,观察到装置B中______时表明碱式碳酸铜已经完全分解。
(3)反应结束后,再缓缓鼓入一段时间氮气的目的是___________。
(4)该碱式碳酸铜的化学式是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐在生产和生活中应用广泛。
(1)下列物质露置于空气中一段时间后,会因变质而使溶液质量明显增加的是_(填字母代号)。
A 食盐水
B 浓硫酸
C 烧碱溶液
D 石灰水
(2)硫酸铵与熟石灰混合施用会降低肥效,有关反应的化学方程式为_。
(3)实验课上,小强将生锈铁钉放入稀盐酸中,观察到铁锈(主要成分是氧化铁)逐渐溶解,并有气泡产生,溶液由无色逐渐变为黄色,除去铁锈的化学方程式为_,请解释产生气泡的原因_。
(4)某同学为了除去NaCl溶液中的CaCl2、MgCl2、Na2SO4杂质制取精盐,设计如下实验流程:

①操作a和操作b都要用到的玻璃仪器是_。
②写出一个可使精盐中氯化钠质量增加的化学方程式_。
③固体B的成分是什么?__。
(5)取10g氯化钠溶液于烧杯中,加入足量的硝酸银溶液,充分反应后过滤,将滤渣洗涤烘干后得到2.87g固体,请计算该氯化钠溶液中溶质的质量 __ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究过氧化氢的分解反应,同学们进行了以下实验。
(查阅资料)过氧化氢分解放热。当氧气低于一定浓度时,可燃物无法燃烧。
(进行实验)
初步探究:探究影响过氧化氢分解速率的因素
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如下图所示。
实验方案 | 序号 | 实验现象 |
| 烧杯1 | 木条复燃,燃烧很旺 |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
span>
(结论与解释)
(1)写出烧杯1中反应的化学方程式_______。
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是_______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是_____(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是_______。
(反思与评价)
(5)烧杯4中木条熄灭的原因可能是_______。
(6)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是_______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小兵和小东是某校化学研究性学习小组的成员,他们在查阅资料时,发现单质碳能够在高温时与金属氧化物反应得到金属单质。于是,他们用木炭与CuO进行了如下的探究活动。请你参与他们的这次活动,并解决有关问题。
(提出问题)木炭与氧化铜反应除生成单质铜外,另一种生成物是什么?
(猜想与假设)猜想一:可能是CO;猜想二:可能是CO2。
(设计实验方案)
(1)检验CO2的方法是__________(用化学方程式表示)。
(2)为了检验CO,他们设计的方案是:把小动物放在收集的气体中,观察能否存活。后经充分研究,认为此方案不能说明问题,其理由是____________
(查阅资料)他们在互联网上收集到这样一条信息:把滤纸浸泡在磷钼酸和氯化钯的黄色混合溶液中制成的试纸遇CO立即变成蓝色,而遇CO2不变色。
(实验与结论)设计的实验装置图如下图所示,请完成下边的表格。
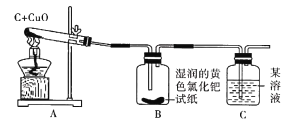
实验现象 | 实验结论 |
A中固体由黑色变成红色 | 有金属铜生成 |
B中黄色试纸没有变蓝 | 没有______生成 |
C中_________ | 有CO2生成 |
(反思与评价)如果A装置中的试管口高于试管底部,在实验过程中可能造成的后果是_____。
(注意:若答对第(3)小题奖励2分,化学试卷总分不超过40分。)
(3)对下列三种氧化铜和碳的质量比例,你建议选择_______(填序号)的比例。
A 38:3 B 40:3 C 42:3
你这样选择的理由是__________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】控制变量法是实验探究的重要方法,下列实验方法的设计中,能达到实验目的是( )
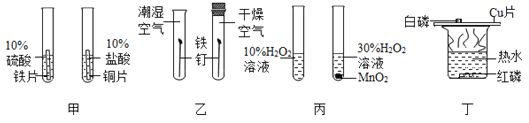
A.图甲比较铁、铜的金属活动性强弱
B.图乙探究金属的锈蚀是否需要水
C.图丙探究MnO2对H2O2分解的催化作用
D.图丁探究可燃物的燃烧是否需要达到一定温度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质分别是高炉炼铁三种原料的主要成分,A~J 是初中化学常见的物质, 它们有如下转化关系(部分反应的生成物和反应条件已略去)。已知 B 在大气中的存在产生了温室应,H是通常状况下密度最小的气体,D 和 G 可以发生中和反应。

请回答下列问题:
(1)写出化学式: 甲______________, B______________;
(2)写出符合要求的化学方程式:
反应② ___________________,
反应③_____________________;
(3)在上述转化中,I 和 J 两种物质的组成元素相同,且反应⑤属于化合反应,则反应⑤的化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com