考点:实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,有关溶质质量分数的简单计算,质量守恒定律及其应用,根据化学反应方程式的计算
专题:科学探究,综合计算(图像型、表格型、情景型计算题)
分析:【猜想假设】(1)化学反应前后,元素的种类不变,原子的种类和个数不变;
【实验探究】
(2)无水硫酸铜是白色的,能和水反应生成蓝色的五水硫酸铜,二氧化碳能使澄清的石灰水变浑浊,一氧化碳能和氧化铁反应生成铁和二氧化碳;
(3)气体通过溶液时,能够带出水蒸气,氢氧化钠溶液能够吸收二氧化碳;
(4)根据装置中的药品和装置的位置来分析;
(5)根据一氧化碳还原氧化铁的现象来分析;
(6)尾气中含有有毒的一氧化碳;
【定量计算】比较第一、二、三次的数据可知:20g盐酸完全反应可以消耗碳酸钙16g-11g=5g;第三次中仅减少了6g-3.2g=2.8g后,没有减少到5g,说明样品中含有3.2g杂质,即n的数值为3.2.同时可以说明第三次所加的盐酸没有反应完.由样品质量和杂质质量就可以计算出样品中碳酸钙的质量分数.利用化学方程式进行相关计算.
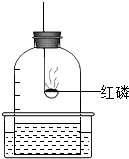
解答:解:(1)酒精燃烧不能生成氨气,因为反应物中不含有氮元素,所以不可能生成含有氮元素的氨气.
故填:丙;化学反应前后元素的种类不变.
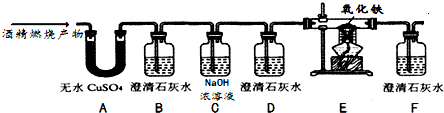
(2)实验中观察到A中无水CuSO
4变蓝,说明甲烷燃烧生成了水;B中澄清石灰水变浑浊,说明甲烷燃烧生成了二氧化碳;E中澄清石灰水变浑浊,D中红色粉末变成黑色,说明甲烷燃烧生成了一氧化碳,由此可知,因为燃烧生成了一氧化碳、二氧化碳和水,丁同学的猜想成立;故填:丁;
(3)如果A、B装置的顺序颠倒,则混合气体从B中出来后,会带上水蒸气,再通过A装置时,如果无水硫酸铜变蓝色,使硫酸铜变蓝色的水可能是甲烷燃烧产生的,也可能是从石灰水中挥发出来的,也可能是二者都有,这样就影响了水的鉴别.故填:否;无法检验是否含水;
(4)B装置的作用检验酒精燃烧生成了二氧化碳;D装置是检验CO
2是否被NaOH溶液完全吸收;F装置是检验是否有二氧化碳生成;故填:检验酒精燃烧生成了二氧化碳;检验CO
2是否被NaOH溶液完全吸收; 检验是否有CO
2生成;
(5)在高温的条件下,一氧化碳将红色的氧化铁还原为黑色铁粉,同时生成二氧化碳;故填:红色粉末变为黑色;
(6)排放出的尾气中含有一氧化碳,有毒会污染空气;故填:没有对尾气进行处理;
【定量计算】
Ⅰ、比较第一、二、三次的数据可知:20g盐酸完全反应可以消耗碳酸钙16g-11g=5g;
第三次中减少了6g-3.2g=2.8g<5g.
说明剩余的3.2g固体全部为样品中杂质的质量,即n的数值为3.2.
同时说明第三次所加的盐酸没有反应完,第四次所加盐酸未反应.
样品中碳酸钙的质量分数为
×100%=80%.故填:3.2;80%;
Ⅱ、由上述计算可知,第1次和第2次盐酸已经完全反应;故填:第1次和第2次;
Ⅲ、计算时选择盐酸完全参与反应的第1次或第2次的数据.
解:设稀盐酸中溶质的质量分数为x
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 73
16g-11g x×20g
=x=18.25%
答:所用稀盐酸溶液中氯化氢的质量分数为18.25%.
点评:含有碳元素的物质燃烧时,如果燃烧充分,生成二氧化碳,如果燃烧不充分,会生成一氧化碳,这样不仅浪费燃料,还会污染环境.本题主要考查含杂质物质的化学方程式的计算,难度较大.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 根据水的电解实验装置图回答问题
根据水的电解实验装置图回答问题