生活处处皆化学.
(1)生活中的燃烧
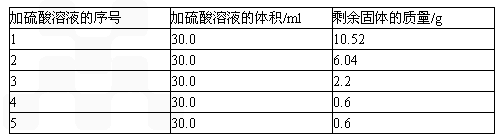
①着火点比较:蜂窝煤
>
>
小木条(填“>”、“<”或“=”).生煤炉过程中,不断扇入空气目的是
与氧气充分接触
与氧气充分接触
,煤不完全燃烧产生一种有毒气体的化学式是
CO
CO
;
②用水灭火的原理是
水蒸发吸热,使温度降低到着火点以下
水蒸发吸热,使温度降低到着火点以下
,新型水成膜泡沫灭火剂扑灭油类火灾时,析出的液体和泡沫在油面上铺展形成一层水膜,进而灭火,原理是
隔绝氧气
隔绝氧气
.
(2)金属在生活中用途广泛
①如图1下列生活用品,主要是由金属材料制成的是
AC
AC
;

品名:504双吸剂
成分:铁粉、NaCl、炭粉CaO等 |
图3
②用铁锅烹饪食物时,会有少量铁屑在胃部转化为可被吸收的Fe
2+,反应的化学方程式为
Fe+2HCl═FeCl2+H2↑
Fe+2HCl═FeCl2+H2↑
,是
置换
置换
反应(填基本反应类型).
③用铝箔包装药物,主要利用了铝的
延展
延展
性;
④铜具有很好的
导电
导电
性,故可作导线.近代湿法冶金的先驱是指
Fe+CuSO4═FeSO4+Cu
Fe+CuSO4═FeSO4+Cu
(填化学方程式),铜和空气中的O
2、H
2O及
CO2
CO2
会生成铜锈[Cu
2(OH)
2CO
3],反应的化学方程式是
2Cu+O2+H2O+CO2═Cu2(OH)2CO3
2Cu+O2+H2O+CO2═Cu2(OH)2CO3
.
(3)生活中的水和溶液
①处理自然水时,常用的混凝剂是
明矾
明矾
(填名称).二氧化氯是一种新型的消毒剂,其化学式为
ClO2
ClO2
;
②欲配制500mL 0.9%的生理盐水(密度为1.0g/mL),需要NaCl的质量为
4.5
4.5
g;配制过程中,玻璃棒的作用是
搅拌,加快溶解
搅拌,加快溶解
,称量NaCl时,若将砝码放在左盘(1g以下用游码),其他操作均正确,则所配溶液中溶质质量分数将
<
<
0.9%(填“>”、“<”或“=”)
③图2是净化河水的简易装置,下列说法正确的是
D
D
;
A.净化后的水是纯净物 B.此装置能对水杀菌消毒
C.此装置能把硬水变为软水 D.活性炭能吸附水中的色素及异味
④KNO
3可用作配制无土栽培营养液,下表提供了KNO
3在不同温度时的溶解度:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
| 溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
169 |
a.从上表可总结出KNO
3的溶解度随温度变化的趋势是
随温度升高而增加
随温度升高而增加
;
b.20℃时,将20gKNO
3加入50g水中充分溶解,所得溶液的质量为
65.8
65.8
g;
c.现有60℃时的KNO
3饱和溶液210g,降温至20℃,会析出KNO
378.4
78.4
g;
(4)食品包装学问大
①我区特产--嘶马羊耳采用真空包装,延长了食品的保质期,原理是
隔绝氧气,杜绝缓慢氧化
隔绝氧气,杜绝缓慢氧化
;
②将N
2充入包装袋内做保护气,是因为N
2的化学性质
稳定
稳定
(填“活泼”或“稳定”);
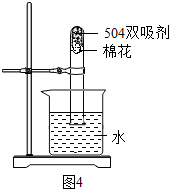
③图3是“504双吸剂”的标签,请问答下列问题:
a.其中至少含有
2
2
种单质;
b.取少量双吸剂加入蒸馏水中,振荡后静置,测得上层清液的pH=9,若用pH试纸测定,具体操作是
用玻璃棒蘸取一滴上层清液,滴在pH试纸上,待颜色不再变化时和标准比色卡对照,读数
用玻璃棒蘸取一滴上层清液,滴在pH试纸上,待颜色不再变化时和标准比色卡对照,读数
.通入CO
2后,上层清液变浑浊,写出上述变化的化学方程式
H2O+CaO═Ca(OH)2
H2O+CaO═Ca(OH)2
、
Ca(OH)2+CO2═CaCO3↓+H2O
Ca(OH)2+CO2═CaCO3↓+H2O
;
c.为测定此双吸剂的使用效果,取足量双吸剂做了如图4所示的实验,一段时间后,进入试管中水的体积
>
>
21%(填“>”、“<”或“=”),理由是
此双吸剂能同时吸收空气中的O2和CO2,也可吸收H2O
此双吸剂能同时吸收空气中的O2和CO2,也可吸收H2O
;
d.部分失效的双吸剂中,有红棕色固体,其主要是
氧化铁
氧化铁
;
e.此双吸剂中,NaCl的作用可能是
加快双吸剂中铁粉吸收O2的速率
加快双吸剂中铁粉吸收O2的速率
.

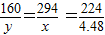
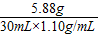 ×100%=17.8%;
×100%=17.8%;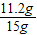 ×100%=74.7%.
×100%=74.7%.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案