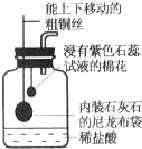
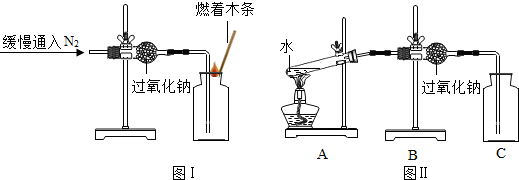
(2013?泉州质检)兴趣小组同学在实验室处理废液时,将一瓶已经有结块的熟石灰取样,加入含有盐酸的废液中,发现废液中产生大量气泡.同学们为进一步了解这瓶熟石灰变质的程度,进行以下探究活动,请你协助完成.
【探究活动一】测定变质的熟石灰样品中碳酸钙的质量分数
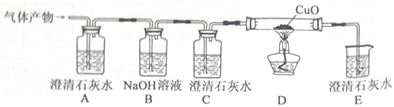
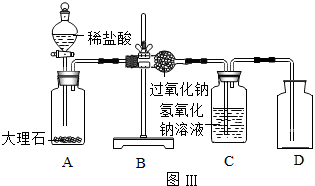
经老师的指导,同学们设计了如图所示实验装置(铁架台略去)进行实验,称取一定量的样品,通过测定样品和稀盐酸反应产生的气体的重量.计算碳酸钙的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).
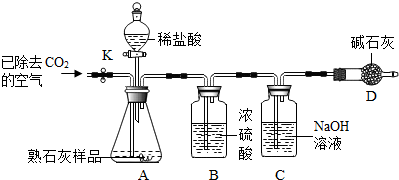
查阅资料:浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
(1)加入足量的稀盐酸,装置A中样品产生气体的化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.
(2)实验过程中,装置B的作用是
干燥二氧化碳气体
干燥二氧化碳气体
;装置C中发生反应的化学方程式为
CO2+2NaOH═Na2CO3+H2O.
CO2+2NaOH═Na2CO3+H2O.
;通过测定装置C在实验前后的质量,其增加的质量即为样品与稀盐酸发生反应的
二氧化碳
二氧化碳
气体的质量.
(3)往装置A中加入盐酸前,打开铁夹k,先对装置A和B(已连接)通入已除去CO
2的空气一会儿,以排尽装置A和B含有CO
2的空气.再接上装置C和D;加入稀盐酸,待装置A中的反应结束后,必须再一次打开铁夹k,继续往装置通入已除去CO
2的空气一会儿,否则实验数据明显偏小,这是因为
A、B装置内的一部分二氧化碳未与氢氧化钠反应
A、B装置内的一部分二氧化碳未与氢氧化钠反应
.经实验测定该变质的熟石灰样品中碳酸钙的质量分数为65%.若没有装置D,将会使测定结果
大于65%
大于65%
(选填“大于65%”或“小于65%”).
(4)同学们认为,该瓶变质的熟石灰仍可用于配制澄清的石灰水.请简述理由
碳酸钙难溶于水
碳酸钙难溶于水
.