

| 实验序号 | 实验操作 | 实验现象 | 解释及结论 |
| 实验I | 用砂纸擦去镁条表面氧化膜,将其放入盛有适量饱和碳酸氢钠溶液的试管中 | 迅速反应,产生大量气泡和白色不溶物N | / |
| 实验Ⅱ | 将实M气体点燃,并在火焰上方罩一干、冷的小烧杯 | 气体安静燃烧、产生淡蓝色火焰,烧杯内壁有水雾出现 | 气体M是H2,燃烧的化学方程式为 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
分析 实验Ⅱ:迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变分析出是氢气,再根据方程式的写法写出方程式;
[猜想与假设]根据题中信息进行猜想解答;
实验Ⅲ:①加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;
②根据B中碱石灰质量的增加量就是生成的二氧化碳的质量,根据二氧化碳的质量计算出碳酸镁的质量,剩余的就是氢氧化镁的质量;
解答 解:实验Ⅱ:迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变,该气体可能是氢气或一氧化碳,如果测定是一氧化碳时,燃烧后需要用到澄清石灰水,所以该气体是氢气;氢气燃烧的反应物是氢气和氧气,生成物是水,反应条件是点燃,所以方程式是:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
[猜想与假设](1)N可能为Mg(OH)2
(2)N可能为MgCO3
(3)N可能是
实验Ⅲ:①加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是稀盐酸(或稀硫酸),有气泡产生,说明含有碳酸镁;
②B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为8.8g,设生成8.8g二氧化碳,需要碳酸镁的质量为X则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
X 8.8g
$\frac{84}{X}=\frac{44}{8.8g}$
X=16.8g,所以含有氢氧化镁质量为:22.6g-16.8g=5.8g;
答案:
实验Ⅱ:
H2 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
探究二:②Mg(OH)2 和MgCO3的混合物;
实验Ⅲ:①稀盐酸; 碳酸镁; ②氢氧化镁
点评 本题难度较大,考查全面,从定性和定量两个方面测定物质的种类,关键在于知道碳酸根离子与酸反应能产生二氧化碳.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 选项 | 实验 | 现象 | 结论 |
| A | 在空气中点燃纯净的氢气 | 燃烧,火焰为淡蓝色 | 氢气能支持燃烧 |
| B | 将铁丝和铜丝分别放入稀盐酸中 | 铁丝表面有气泡产生,铜丝表面无变化 | 铁的金属活动性比铜强 |
| C | 将二氧化碳通入紫色石蕊溶液中 | 紫色石蕊溶液变成红色 | 二氧化碳显酸性 |
| D | 高温下,将一氧化碳通过氧化铁粉末 | 黑色粉末变为红色 | 一氧化碳具有还原性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验 | 结晶温度/℃ | 结晶时间/min | 转化率% |
| a | 20 | 30 | 53.15 |
| b | 40 | 30 | 84.12 |
| c | 40 | 45 | 63.00 |
| d | 60 | 60 | 62.20 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
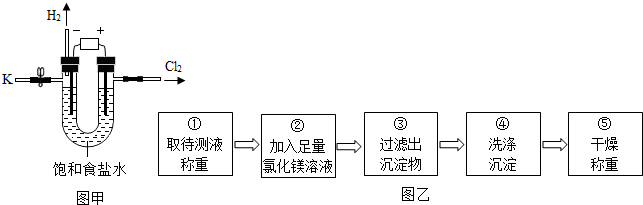
| 实验步骤 | 实验现象 | 实验结论 |
取样,滴加几滴无色酚酞试液 | 溶液变红色 | 待测液呈碱性,表明含有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
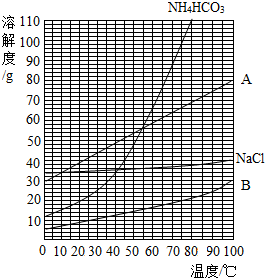 以饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl.(已知NH4HCO3在40℃受热易分解)
以饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl.(已知NH4HCO3在40℃受热易分解)| 实验序号 | 反应温度/℃ | 反应时间/min | NaHCO3产率/% |
| a | 30 | 60 | 86.8 |
| b | 30 | 120 | X |
| c | 35 | 60 | 89.4 |
| d | 35 | 120 | 92.5 |
| e | 40 | 60 | 85.3 |
| f | 40 | 120 | 85.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com