
| 质量 |
| 密度 |
| 溶质的质量 |
| 溶液的质量 |
| 3.0g+1.2g |
| 0.6g+0.4g+17.15g-0.05g |


科目:初中化学 来源: 题型:阅读理解
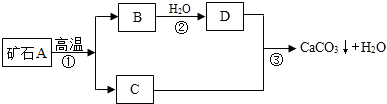
 【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.| 实验次数 项目 |
第一次 | 第二次 | 第三次 |
| 所取矿石A的质量/g | 12 | 12 | 15 |
| 所加稀盐酸的质量/g | 120 | 150 | 100 |
| 剩余物质的质量 | 127.6 | 157.6 | 110.6 |
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省泰州市海陵区九年级上学期期末考试化学试卷(解析版) 题型:计算题
(6分)向一定量的碳酸钙中加入100克溶质质量分数为7.3%的稀盐酸,恰好完全反应。请计算:
(1)所用碳酸钙的质量;
(2)反应后所得溶液中溶质质量分数是多少?(结果保留到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

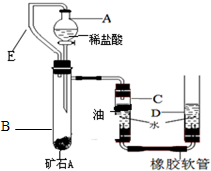 【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.| 实验次数 项目 | 第一次 | 第二次 | 第三次 |
| 所取矿石A的质量/g | 12 | 12 | 15 |
| 所加稀盐酸的质量/g | 120 | 150 | 100 |
| 剩余物质的质量 | 127.6 | 157.6 | 110.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
I: 牙膏是人们生活中的必需品,在牙膏的生产中常添加一种摩擦剂。这种摩擦剂是由某种自然界中分布很广的矿石A,经过一系列加工而制得的极细小的轻质碳酸钙粉末,其生产过程如下:
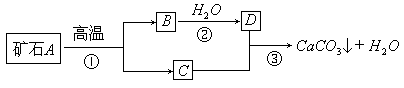
试回答:
(1)写出 C、D两种物质的化学式 C_____D_____
(2)写出③反应的化学方程式_______________________
(3)反应③制轻质碳酸钙粉末后,还要通过 (填操作)将其从反应后的混合物中分离出来。实验室进行该操作时主要用到的玻璃仪器有:烧杯、玻璃棒、
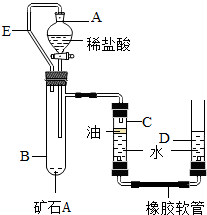
II、某兴趣小组为了测定本地所产矿石A的纯度,利用下图装置设计了以下实验方案:
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数。
【实验步骤】
①连接装置并检查装置气密性;
②在试管B中加入10克矿石A,分液漏斗中加入足量的稀盐酸,C、D管中加入一定量的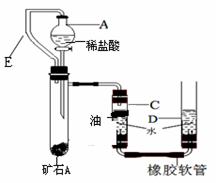 水,C管的液面上加一 层油,并将分液漏斗A和试管B用长导管E连接起来。
水,C管的液面上加一 层油,并将分液漏斗A和试管B用长导管E连接起来。
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加稀盐酸至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中
|
![]() 体密度为ρg/L);
体密度为ρg/L);
⑥计算气体的质量并由此求出矿石A中碳酸钙的质量分数
【实验分析】
(1)小明同学认为在实验前要将矿石A 全磨成粉末状,你认为他的目的是:
;
(2)小洁同学认为该实验的设计中最经典的是连接仪器A和仪器B的橡胶管E,你认为如果没有橡胶管E,则会对实验结果产生何种影响?
(3)检查该装置的气密性时,如图准备好装置,在C、D两管中装好水且液面相平,提高D管, ,则气密性良好;
(4)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验:清判断并说明理由 。
(5)实验结束时同学们才发现由于粗心,小伟将植物油加到了D管的水面上,大家一致认为由于该粗心将会导致测得的矿石A中碳酸钙的质量分数产生误差,你认为该误差是 (填偏大或偏小) 。
(6)化学老师看了他们的实验设计后,对他们的设计方案和合作意识、探究精神都给予了很高的评价,并对他们进行启发:二氧化碳的质量可以根据质量守恒定律,测反应前后烧杯中剩余物质的质量之差来求得,于是他们又在烧杯中进行了如下的实验测定:
| 实验次数 项目 | 第一次 | 第二次 | 第三次 |
| 所取矿石A的质量/g | 12 | 12 | 15 |
| 所加稀盐酸的质量/g | 120 | 150 | 100 |
| 剩余物质的质量 | 127.6 | 157.6 | 110.6 |
请你和他们一起完成实验数记的分析和计算:
①当所取矿石A和稀盐酸的质量比 时,矿石A和稀盐酸恰好完全反应。
②矿石A中碳酸钙的质量分数是多少?(2分)
③所用稀盐酸的溶质质量分数是多少?(2分)
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省扬州中学树人学校九年级(上)期末化学试卷(解析版) 题型:解答题

| 实验次数 项目 | 第一次 | 第二次 | 第三次 |
| 所取矿石A的质量/g | 12 | 12 | 15 |
| 所加稀盐酸的质量/g | 120 | 150 | 100 |
| 剩余物质的质量 | 127.6 | 157.6 | 110.6 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com