在“氧气的制取和性质”实验课中,某同学取一段纱窗网上的细铁丝,在自己收集到的氧气中做“铁丝在氧气中燃烧”的实验.结果没有观察到“火星四射”的现象,请分析此实验失败的一种可能原因:
铁丝已经生锈(或收集的氧气不纯;温度没有达到铁的着火点等
铁丝已经生锈(或收集的氧气不纯;温度没有达到铁的着火点等
.若经改进实验成功了,其反应的化学方程式为
.用来测定空气成分的方法很多,如图1所示的是用红磷在空气中燃烧的测定方法.实验过程是:
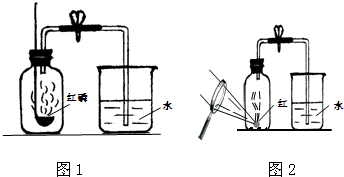
第一步:将集气瓶容积划分为五等份,并做好标记.
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧.
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的
.
请回答下列问题:
(1)集气瓶中剩余的气体主要是
氮气
氮气
.
(2)实验完毕,若进入集气瓶中水的体积不到总容积的
,你认为导致这一结果的原因可能是
红磷的量不足
红磷的量不足
、
装置漏气
装置漏气
.
(3)某同学对实验进行反思后,提出了改进方法(如图2所示 ),你认为改进后的优点是:
用凹透镜将太阳光聚焦引燃红磷,避免因拨出橡皮塞引燃红磷造成气体逸出,造成实验误差,同时还可避免五氧化二磷逸散到空气中污染空气.
用凹透镜将太阳光聚焦引燃红磷,避免因拨出橡皮塞引燃红磷造成气体逸出,造成实验误差,同时还可避免五氧化二磷逸散到空气中污染空气.
;太阳光
节省能源,无污染
节省能源,无污染
.
结合下列图示装置,回答有关问题.
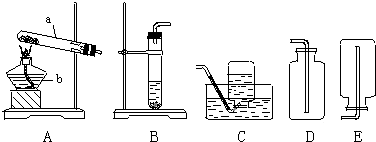
(1)写出编号所指仪器的名称:a
试管
试管
;b
酒精灯
酒精灯
.用A装置制取某种气体的一个化学方程式为
.
(2)实验室中,用加热高锰酸钾的方法制取氧气,发生装置可选用
A
A
(填标号);用向上排空气法收集氧气,应如何验满?
将带火星的木条放在集气瓶口,若带火星的木条复燃,说明收集已满
将带火星的木条放在集气瓶口,若带火星的木条复燃,说明收集已满
.
(3)氢气是最清洁的燃料,它的密度比空气小,难溶于水,实验室常用锌粒与稀硫酸反应来制得.其化学方程式为
Zn+H2SO4═ZnSO4+H2↑,
Zn+H2SO4═ZnSO4+H2↑,
.收集氢气的装置可选用
C
C
或
E
E
.(填标号)

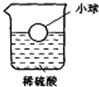 将一个不与稀硫酸反应的小球放入盛有稀硫酸的烧杯中,小球漂浮在液面上,如图所示.若再向烧杯中加入一定量的铁粉(铁粉的体积忽略不计),则在产生气体的同时,小球将( )
将一个不与稀硫酸反应的小球放入盛有稀硫酸的烧杯中,小球漂浮在液面上,如图所示.若再向烧杯中加入一定量的铁粉(铁粉的体积忽略不计),则在产生气体的同时,小球将( )


 将A、B、C和锌四种金属分别同时放入稀盐酸中,小明将观察到的现象形象的画了一幅卡通画,每个卡通人物表示一种金属,周围的小黑点表示反应中生成的气体.问:
将A、B、C和锌四种金属分别同时放入稀盐酸中,小明将观察到的现象形象的画了一幅卡通画,每个卡通人物表示一种金属,周围的小黑点表示反应中生成的气体.问: