
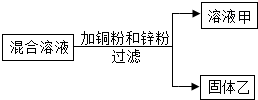
 某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:
某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 在金属活动性顺序中:Al>Zn>Cu>Ag,根据排在前面的金属可以把位于它后面的金属从其盐溶液中置换出来,可简记为“前置后,盐可溶”.
解答 解:根据金属活动性Al>Zn>Cu>Ag,所以锌粉优先与AgNO3发生反应,铜粉后与AgNO3发生反应,但是铜粉和锌粉都不能和Al(NO3)3发生反应,Al(NO3)3一定在溶液中;
①锌粉优先与AgNO3发生反应生成硝酸锌和银,固体乙中一定含有Ag,可能有Cu和Zn,说法正确;
②锌粉优先与AgNO3发生反应生成硝酸锌和银,铜粉和锌粉都不能和Al(NO3)3发生反应,所以溶液中一定有Al(NO3)3和Zn(NO3)2,说法正确;
③若溶液甲是蓝色,说明铜已经与AgNO3发生反应,而锌已经全部反应,溶液甲一定含有Al(NO3)3、Zn(NO3)2和Cu(NO3)2;故说法错误;
④若溶液甲是无色,则锌和硝酸银是一定要反应的,溶液中应该一定有硝酸锌的,说法错误;
⑤向固体乙上滴加盐酸有气泡产生,说明固体中有锌,锌过量,铜未参加反应,溶液中AgNO3被反应完全,溶液甲中一定没有AgNO3和Cu(NO3)2,说法正确.
故选:C.
点评 本题考查了金属活动性顺序及其应用,同学们应该熟记金属活动性顺序及其意义进行.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
 如图是稀释浓硫酸实验的示意图.
如图是稀释浓硫酸实验的示意图.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ,请回答下列问题:
,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2在空气中燃烧的火焰为淡蓝色 | |
| B. | 利用H2的还原性可以进行金属冶炼 | |
| C. | 氢气是一种新能源 | |
| D. | 收集满氢气的集气瓶应正放在桌子上 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH、NaCl、K2SO4 | B. | MgSO4、Cu(NO)3、KCl | ||
| C. | KNO3、ZnCl2、Ca(NO3)2 | D. | CaCl2、(NH4)2SO4、K2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
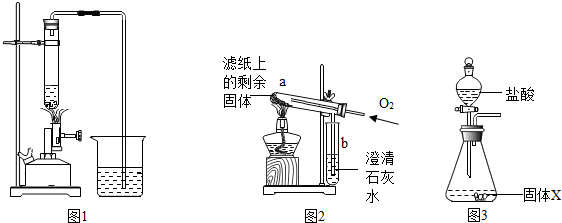
| 步骤 | 操作 | 主要现象 | 结论 |
| Ⅰ | 取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引. | 部分固体被吸引到磁铁上 | 可能有Fe或Fe3O4 |
| Ⅱ | 取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热. | 固体剧烈燃烧,b中溶液变浑浊 | 一定有C |
| Ⅲ | 另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸. | 无明显现象 | 一定没有FeO和Fe2O3 |
| Ⅳ | 取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸. | 产生气泡. | 一定有Fe |
| Ⅴ | 在步骤IV所得溶液中逐滴加入KSCN溶液. | 溶液不变红色 | 一定没有Fe3O4 |
| 步骤 | 操作 | 数据 |
| Ⅰ | 重新取部分冷却至室温的固体X,称量其质量为m1. | m1=17.9g |
| Ⅱ | 将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3. | m2=317.9g m3=317.3.g |
| Ⅲ | 将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4. | m4=1.1g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com