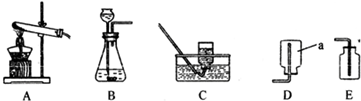
解:(1)①白磷立即着火燃烧,产生大量白烟,生成五氧化二磷,化学方程式为4P+5O
2
2P
2O
5;
②白磷燃烧放出大量的热,使集气瓶中压强增加,大于大气压强,液面下降,空气中的氧气被消耗,熄灭冷却后,集气瓶中的压强小于大气压强,液面上升,所以集气瓶中水面先下降后上升;
③由于氧气约占空气体积的五分之一,进入的水也是这一比例,则最终集气瓶中水的体积为:a+
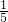
v;
(2)由于温度的改变会影响水的进入,所以需要使集气瓶温度尽快降低至室温,同时水也对吸收产物有一定作用.
“a体积的水”的作用,其一是为了加快⑤步骤中集气瓶的冷却速度;其二主要是吸收白磷燃烧生成的五氧化二磷; (3)小明的观点正确,白磷燃烧生成的五氧化二磷溶于水显酸性,滴加几滴紫色石蕊试液,会变红.
故答案为:
(1)4P+5O
2
2P
2O
5,先下降后上升,a+
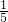
v;
(2)吸收白磷燃烧生成的五氧化二磷
(3)小明,可能是白磷燃烧生成的五氧化二磷溶于水(或与水反应),导致溶液显酸性.
分析:(1)白磷与氧气反应生成五氧化二磷;利用白磷和氧气反应放热、氧气的量约占空气体积的五分之一解决问题;
(2)围绕“降温以及吸收燃烧产物”这一因素进行分析;
(3)从使石蕊试液变红色的溶液显酸性的知识进行猜想.
点评:空气中氧气含量的测定也是中考考查的一个热点,重点考查实验过程中看到的现象以及导致实验结果偏大或偏小的原因.

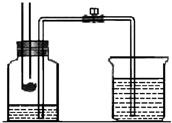 某校化学学习小组在学习了“空气中氧气含量测
某校化学学习小组在学习了“空气中氧气含量测 2P2O5;
2P2O5;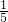 v;
v; 2P2O5,先下降后上升,a+
2P2O5,先下降后上升,a+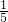 v;
v;

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案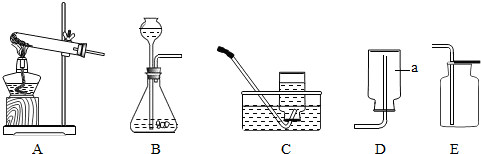
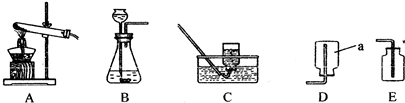
 某校化学研究性学习小组共同探究制取气体的原理、方法的有关实验.某同学将所学气体制取的知识整理如下,请你帮助他完成相关内容.
某校化学研究性学习小组共同探究制取气体的原理、方法的有关实验.某同学将所学气体制取的知识整理如下,请你帮助他完成相关内容.