
分析处理图表中的信息是学习化学的一种重要方法。
(1)表3是 氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:

① 40℃时,氯化钠的溶解度为____________g。
②碳酸钠的溶解度随温度的升高而____________(填“增大”或“减小”)。在20℃时,
将100g的水加入30 g碳酸钠中,充分搅拌后得到的是____________(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30度,该溶液的溶质质量分数为____________ (计算结果精确到0.1%)。
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是______。
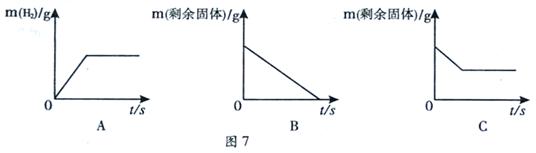
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式________________________。图7是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是____________(填标号)。
【答案】(1) ① 36.6 ② 增大 饱和溶液 23.1% ③  碳酸钠饱和溶液
碳酸钠饱和溶液
(2) Fe + 2HCl = FeCl2+H2↑ A C
【解析】
试题分析:从表格看40℃时,氯化钠的溶解度为36.6克;碳酸钠的溶解度随温度的升高而增大;将100g的水加入30 g碳酸钠中,充分搅拌后得到的是饱和溶液,因为此时碳酸钠的溶解度是21.8克,将上述溶液升温到30度溶解度变为39.7克,所以30克碳酸钠完全溶解,该溶液的溶质质量分数为=30克/130×100%= 23.1%;10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液,因为该温度时碳酸钠的溶解度小于氯化钠的溶解度;足量的稀盐酸加入一定量的铁、铜混合物中,其中能够反应的是铁和盐酸,其化学方程式为Fe + 2HCl = FeCl2+H2↑;A能够表示产生氢气的质量和时间的关系,因为开始后就会有气体产生,随着反应的进行气体质量不断的变大,但是当反应完后气体的质量就不会变化了;其中C能够表示固体的质量与时间的关系, 银随着反应其中的铁会慢慢被反应掉,使得质量减少,但是最后铜不会反应,所以固体的质量不会变为零。
银随着反应其中的铁会慢慢被反应掉,使得质量减少,但是最后铜不会反应,所以固体的质量不会变为零。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
有一包白色粉末,可能由氯化钠、硫酸钠、硫酸铜、碳酸钠、碳酸钙中的一种或几种组成,为确定其组成,进行如下实验:
①称取一定质量的该白色粉末加足量水溶解,得无色溶液A.
②在无色溶液A中加入过量氯化钡溶液,充分反应后过滤,分别得无色溶液B和白色沉淀C;将白色沉淀C洗涤,烘干后称得质量为20g.
③在20g白色沉淀C中加入足量的稀硝酸,沉淀部分消失,并有气泡冒出.
④在无色溶液B中滴加硝酸银溶液和稀硝酸,产生白色沉淀.
由上述实验得出的下列判断中,正确的是()
A. 白色粉末中不含碳酸钙、硫酸钠、硫酸铜
B. 无色溶液B中一定含有两种溶质
C. 白色粉末中一定含有氯化钠
D. 步骤③生成的气体质量可能是4.4g
查看答案和解析>>
科目:初中化学 来源: 题型:
1)用化学符号填空:①氯化亚铁中的阳离子 ;②标出碳酸钡中钡元素的化合价 ;③三个钙原子________。
(2)①SO3中“3”的含义: ;②Mg2+中“2”的含义: 。
(3)“候氏制碱法”中的的创始人 。
查看答案和解析>>
科目:初中化学 来源: 题型:
如图是A、B两种物质的溶解度曲线,请回答:
(1)在40℃时A、B的溶解度大小关系是 ;
(2)a点是A、B两条曲线的交点,其含义是 ;
(3)20℃时将20gA固体放入50g水中,充分溶解后,所得溶液的质量是 g;
(4)若A中含有少量的B杂质,提纯A的方法是 结晶.

查看答案和解析>>
科目:初中化学 来源: 题型:
甲、乙两物质的溶解度曲线如图2所示.现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯里,然后向烧杯中加入适量的氢氧化钠固体,搅拌至完全溶解(如图1),此时对相应变化的判断正确的是( )

|
| A. | 甲溶液可能变成不饱和溶液 |
|
| B. | 盛乙的试管中未溶解的固体质量减少 |
|
| C. | 甲、乙两物质的溶解度都增大 |
|
| D. | 乙溶液中溶质质量分数减小 |
查看答案和解析>>
科目:初中化学 来源: 题型:
地球是一颗美丽的蓝色星球,海水占了全球水资源的97%.海水资源的开发和利用具有非常广阔的前景.
(1)海水中含有大量的NaCl,可用于制备钠及其化合物,其流程如图:
①加入过量Na2CO3溶液目的是除去CaCl2和 ,流程中不能用过量稀硫酸代替过量稀盐酸的原因是 ;
②提纯过程中使用了过滤和蒸发操作,实验室过滤和蒸发操作均使用到的玻璃仪器是 ;
③流程图中制备金属钠的化学方程式为 .
(2)工业上利用电解饱和食盐水的方法制备NaOH,并同时获得两种单质.补充并配平化学方程式:
□NaCl+□H2O □ +□ +□Cl2↑
□ +□ +□Cl2↑
(3)刘廷在实验室找到一瓶长期放置的NaOH溶液,欲对其成分进行实验探究.
【查阅资料】
I.NaOH与CO2分两步反应:
2NaOH+CO2═Na2CO3+H2O;Na2CO3+CO2+H2O═2NaHCO3
Ⅱ.NaOH与NaHCO3反应方程式为:NaOH+NaHCO3═Na2CO3+H2O
Ⅲ.物质的溶解性:
| CO32﹣ | HCO3﹣ | OH﹣ | |
| Ba2+ | 不溶 | 溶 | 溶 |
;溶液的酸碱性:BaCl2溶液呈中性
【提出猜想】刘廷根据资料中的I、Ⅱ对其成分提出了5种合理猜想,请将猜想补充完整
猜想1:只有NaOH,猜想2: ,猜想3:只有Na2CO3,猜想4: ,
猜想5:只有NaHCO3.
【实验验证】
| 步骤 | 操作 | 现象 | 结论 |
| 步骤1 | 取该NaOH溶液,加入过量BaCl2溶液 | 产生白色沉淀 | 证明猜想 1、5 不成立(填数字) |
| 步骤2 | 取步骤1中上层清液,滴加 稀盐酸 | 无气泡产生 | 证明原溶液不含 HC |
| 步骤3 | 另取步骤1中上层清液,滴加 酚酞 | 溶液未变红 | 证明原溶液不含 OH﹣ (填“离子”) |
【实验结论】
通过以上实验操作得出结论:猜想 是正确的(填数字)
查看答案和解析>>
科目:初中化学 来源: 题型:
 有科学家研究发现,氧气可通过高能真空紫外线照射二氧化碳直接产生,该化学反应模型如图所示。关于该反应的说法错误的是
有科学家研究发现,氧气可通过高能真空紫外线照射二氧化碳直接产生,该化学反应模型如图所示。关于该反应的说法错误的是
A.属于分解反应
B.反应中的最小微粒是分子
C.符合质量守恒定律
D.为制取氧气提供了新方法
查看答案和解析>>
科目:初中化学 来源: 题型:
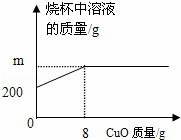
已知烧杯中装有200g硫酸和硫酸铜混合溶液,其中含硫酸铜4.8g.向烧杯中逐渐加入氧化铜,烧杯中溶液的质量与加入氧化铜的质量关系如图所示.当恰好完全反应时,所得的溶液为不饱和溶液.
(提示:CuO+H2SO4=CuSO4+H2O)请计算:
(1)m= g.
(2)原混合溶液中H2SO4的质量分数.
(3)若取恰好完全反应时所得溶液10g配制成20%的硫酸铜溶液,需要30%的硫酸铜溶液多少克?
查看答案和解析>>
科目:初中化学 来源: 题型:
下列的反应中生成物都是C,若C的化学式为AB2,则该反应的化学方程式是( )
A.3 AB2+ B2===2C B.AB+ B2===2C
C.2AB+ B2===2C D.AB2+ 2B2===2C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com