
| A. | +4 | B. | +2 | C. | +1 | D. | -4 |
科目:初中化学 来源: 题型:选择题
| A. | 将PH试纸浸入苹果汁中,测定苹果汁的PH | |
| B. | 将氯化铵溶液滴入酚酞试液中,检验氯化铵溶液的酸碱性 | |
| C. | 将湿润的石蕊试纸沾在玻璃棒上接近SO2,试验气体的性质 | |
| D. | 用玻璃棒蘸取盐酸沾在pH试纸上,观察试纸的颜色变化,测得盐酸的pH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
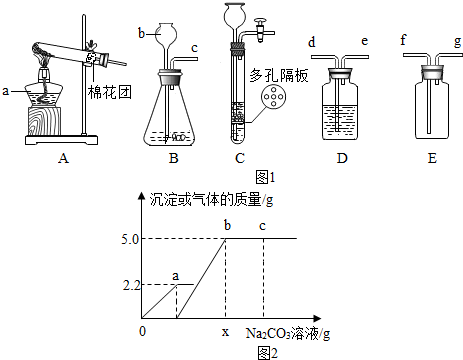
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 它由五种元素组成 | B. | 它的分子中氢、氧原子个数比为2:1 | ||
| C. | 该药物由15个原子构成 | D. | 该药物中碳元素的质量分数最大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
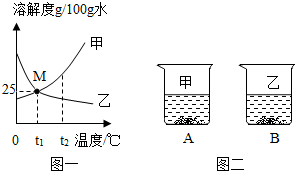 图一为甲、乙两种物质(不带结晶水)的溶解度曲线图.
图一为甲、乙两种物质(不带结晶水)的溶解度曲线图.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 镁条在空气中燃烧,发出耀眼的白光 | |
| B. | 硫在氧气中燃烧,发出明亮的蓝紫色火焰 | |
| C. | 一氧化碳在在空气中燃烧发出淡蓝色火焰 | |
| D. | 细铁丝在氧气中燃烧,火星四射,有黑色固体生成 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 请完成下列相关内容:
请完成下列相关内容:| 实验步骤 | 实验现象 | 实验结论 |
| ①取3.00g变质粉末于一支大试管中,加入适量的水,共收集到0.32g气体,然后用带火星木条检验生成的气体. | 固体完全溶解, 带火星的木条复燃 | 该固体样品中含有Na2O2,其质量为1.56g. |
| ②继续向上述试管中加入足量的石灰水,充分反应. | 有白色沉淀 | 化学方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH. |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体1.00g. | / | / |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com