
| 111 |
| 106 |
| x |
| 10.6g |
| 106 |
| 100 |
| 10.6g |
| y |
| 106 |
| 117 |
| 10.6g |
| z |
| 20.6g |
| 206g |


科目:初中化学 来源: 题型:
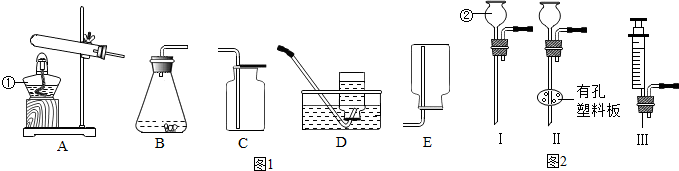
查看答案和解析>>
科目:初中化学 来源: 题型:
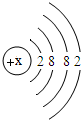 某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图,则该元素的质子数x为
某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图,则该元素的质子数x为查看答案和解析>>
科目:初中化学 来源: 题型:
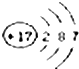 粒子符号为
粒子符号为查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
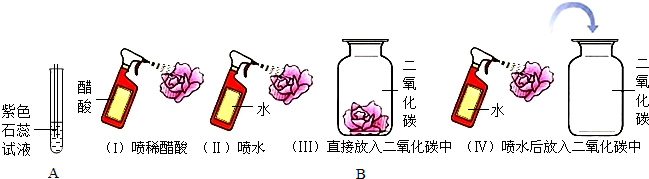
查看答案和解析>>
科目:初中化学 来源: 题型:
| 材料 | 铜 | 塑料 |
| 类别 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com