
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有_____产生,反应的化学方程式是_____。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
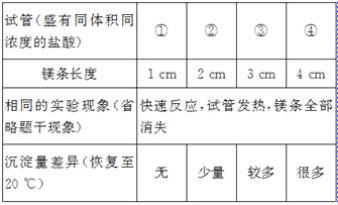
[得出结论]镁条与盐酸反应产生白色沉淀与_____有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是_____(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | _____,白色沉淀_____ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀_____ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是:Mg2+、_____ |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
【答案】气泡 Mg+H2SO4===MgSO4+H2↑ 镁条长度 Mg+2H2O===Mg(OH)2+H2↑ 没有气泡产生 消失 不消失 Cl-
【解析】
镁与稀硫酸反应生成硫酸镁溶液和氢气,在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有气泡产生,反应的化学方程式是Mg+H2SO4===MgSO4+H2↑;
[做出猜想]
由小林同学的实验,镁条长度越长,产生白色沉淀越多,则镁条与盐酸反应产生白色沉淀与镁条长度有关;
由题意,镁能与热水反应产生一种碱和氢气,即镁与热水反应生成氢氧化镁沉淀和氢气,猜想三为氢氧化镁,反应的化学方程式为Mg+2H2O===Mg(OH)2+H2↑。
[实验验证2]
镁与稀盐酸反应生成氯化镁和氢气,由实验结论,猜想一不正确,但这种白色沉淀能溶于盐酸,则没有气泡产生,白色沉淀消失;
20℃时,100g水中最多能溶解氯化镁54.8g,易溶于水,由实验结论,猜想二不正确,则加入足量水,白色沉淀不消失;
C 加入适量稀硝酸,白色沉淀消失,说明白色沉淀能与酸反应;继续滴加几滴硝酸银溶液,出现大量白色沉淀,说明生成了不溶于硝酸的白色沉淀,该沉淀应为氯化银沉淀,则原白色沉淀中含有的离子是:Mg2+、Cl-。因此:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | 没有气泡产生,白色沉淀消失 | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入适量水 | 白色沉淀不消失 | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是:Mg2+、Cl- |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:初中化学 来源: 题型:
【题目】小周在适宜的条件下,利用 KNO3 晶体和溶质质量分数为 20%的 KNO3 溶液,配制一定溶质质量分数的 KNO3 溶液。取 40克 KNO3 晶体置于烧杯中,并依次加入溶质质量分数为 20%的KNO3 溶液并充分搅拌溶解,其过程如图所示:

(1)在配制过程各阶段的溶液中属于饱和溶液的有_____。(填烧杯序号)
(2)计算④号烧杯中溶液的溶质质量分数(结果精确到0.1%)____________。
(3)已知KNO3晶体的溶解度随温度的升高而增大,在不考虑水分蒸发的情况下,在配制过程中,下列操作会导致④号烧杯中溶液的溶质质量分数偏大的有_____。
A 所用 KNO3 晶体混有少量泥沙 B 配制过程中环境温度升高
C 用砝码生锈的天平称取 40克K NO3 晶体 D 溶解时没有用玻璃棒搅拌
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是A、B、C三种物质的溶解度曲线:

请写出三点符合图中溶解度曲线的不同类型的信息。
(1)_______________________________________________________________________。
(2)_______________________________________________________________________。
(3)_______________________________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是a、b、c三种物质的溶解度曲线。由图示判断下列说法中不正确的是 ( )

A.在t1℃时,a的溶解度等于c的溶解度
B. c的溶解度随温度的升高而减少
C. a的饱和溶液从t2℃降温至t1℃时变为不饱和溶液
D.当a中含有少量b时,可以用降温结晶的方法提纯a
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们在课外学习活动中知道了钠和镁着火不能用CO2来灭火。他们通过查阅资料发现Mg能在CO2中燃烧:2Mg+CO2![]() 2MgO+C,但没有找到有关钠能否与CO2反应的介绍.有同学认为钠能发生类似于CO2与镁的反应,可能的化学方程式为_______________。
2MgO+C,但没有找到有关钠能否与CO2反应的介绍.有同学认为钠能发生类似于CO2与镁的反应,可能的化学方程式为_______________。
于是同学们展开了以下探究:
[实验]将燃着的钠伸入装有干燥的CO2的集气瓶中,钠能在CO2中继续燃烧。
[查阅资料]Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH。
[提出猜想]同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出了以下凡种猜想:通过理论分析,猜想________(填序号)肯定是错误的,理由是:______________________________________。
[验证猜想]①Na2O、C ②________、C ③NaOH、C ④Na2O、Na2CO3、C
通过理论分析,猜想________(填序号)肯定是错误的,理由是:__________________。
[验证猜想]
步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
(1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 燃烧产物中肯定有___ |
(2) | 取(1)所得少量上层清液,加入过量的BaCl2溶液 | _________________ | 燃烧产物中肯定有Na2CO3 |
(2) | 取(2)所得少量上层清液,加入_____溶液 | 溶液变成红色 | 燃烧产物中肯定有___ |
在步骤(2)中BaCl2溶液加入至过量的目的是____________________________________。
在步骤(3)中也可以通过加入的________方法进行检验(任写一种试剂)
[结论]猜想________(填序号)正确。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )
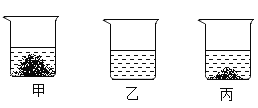
A. 所得溶液可能都是饱和溶液
B. 20℃时,乙溶液的溶质质量最小
C. 溶液溶质的质量分数:甲>丙>乙
D. 升高温度,溶液溶质的质量分数一定变大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】乙醇俗称酒精,可用作医用消毒,也常作燃料。其完全燃烧的化学方程式可表示为:C2H6O+3O2![]() 2 CO2+ 3 H2O 。
2 CO2+ 3 H2O 。
23g乙醇完全燃烧需消耗多少克氧气?
乙醇不完全燃烧会产生一氧化碳,某实验测得反应前后各物质的质量如下表:
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量(g) | 4.6 | 8.8 | 0 | 0 | 0 |
反应后质量(g) | 0 | 0 | 6.6 | 5.4 | a |
①表中a的值为____ __。
②该实验发生反应的化学方程式为:4C2H6O+11O2![]() _____ CO2+ _____ H2O + _____ CO 。
_____ CO2+ _____ H2O + _____ CO 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)下图所示装置有多种用途,利用其进行相关实验。
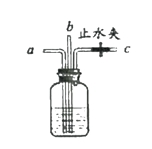
(1)检查装置气密性:关闭止水夹,从a处通入空气,观察到________________________,说明装置气密性良好。
(2)除杂:打开止水夹,从a处缓慢通入O2和CO2的混合气,瓶中液体无明显变化,在c处得到较纯的O2。瓶中盛放的试剂是____________。
(3)获得稳定气流:打开止水夹,从a处通入不稳定的氧气流,在c处获得较为稳定的气流,此时观察到的现象是_______________________________________________。
(4)防止爆炸:气囊中有遇明火能爆炸的H2和O2混合气。将气囊与a处相连,在c处连接尖嘴管,打开止水夹,通入混合气,在尖嘴处点燃气体,没有爆炸,原因是:
①集气瓶中的水能降温和阻断燃烧;②____________________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】维生素C,可能是我们平时最熟悉的维生素,当我们出现口腔溃疡的时候,可能就是由于缺少它引起的。其实,维生素C的作用远不止祛除口腔溃疡,我们若是睡觉之前适量的补充一些维生素C,或许能收获许多好处。维生素C的结构简式如图所示,下列有关叙述错误的是( )
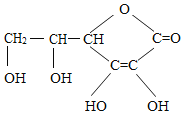
A. 维生素C的化学式为:C6H8O6
B. 维生素C的一个分子中含有20个原子核
C. 维生素 C属于有机高分子化合物
D. 维生素C中碳、氢、氧三种原子质量比为9:1:12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com