
暖宝宝是一种防寒用品,如图所示.暖宝宝中的主要成分有哪些?发热的原因是什么?
(1)小明探究:暖宝宝中的主要成分是什么?剪开内包装袋,倒出其中的粉末,发现呈黑色.
【提出猜想】该黑色粉末可能含有炭粉、铁粉、二氧化锰、氧化铜、四氧化
三铁中的一种或几种.
【初步验证】将磁铁靠近黑色粉末,部分被吸引.
【查阅资料】四氧化三铁具有磁性,能被磁铁吸引.
【得出结论】该黑色粉末可能含有 .
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取黑色粉末加足量稀硫酸 | 固体部分溶解,有气泡产生,溶液无蓝色 |
| ② | 取实验①的残渣灼烧,将内壁涂有 澄清石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 |
由实验①可知,该黑色粉末肯定含 ,肯定不含 .写出实验①的化学反应方程式 .
由实验②可知,该黑色粉末肯定含 .
(2)小明思考:暖宝宝为什么会发热?
【查阅资料】暖宝宝中的铁粉在空气中发生了缓慢氧化,进而放出热量.由此可见,人们可以利用化学反应放出的能量,请再举一例: .
(3)人们利用化学反应还可以 .

答案 解:(1)由于黑色固体物质能够被磁铁吸附,所以要么是本身具有磁性的四氧化三铁,要么是能够被吸附的铁粉.而加入稀硫酸,黑色固体部分溶解产生气泡,在黑色物中只有铁粉和硫酸能够反应得到氢气气体(反应方程式为Fe+H2SO4=FeSO4+H2↑).而溶液无颜色,说明原物质一定不含氧化铜.对固体残渣加热,用石灰水检验时,发现石灰水变浑浊,说明生成了二氧化碳,则原物质一定含有炭粉.
(2)人们对化学反应放热的应用很多,如燃烧燃料做饭、燃烧燃料驱动汽车等交通工具的行走、发射火箭、农家肥的腐熟等.
(3)化学反应可以制造新物质,如各种新材料、研制新药品等.
故答案为:
(1)铁和四氧化三铁; 铁;氧化铜; Fe+H2SO4=FeSO4+H2↑;炭粉.
(2)燃烧燃料做饭等.
(3)制造新物质等.


科目:初中化学 来源: 题型:
青铜是人类最早使用的铜锡合金,下列说法中不正确的是
( )
A.青铜属于纯净物 B.青铜属于金属材料
C.青铜的硬度比铜大 D.青铜耐腐蚀,易铸造成形
查看答案和解析>>
科目:初中化学 来源: 题型:
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能 完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应,浓硫酸可吸收水蒸气)
完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应,浓硫酸可吸收水蒸气)

(1)甲组同学称取一定质量的赤铁矿粉,采用如图的装置进行实验。
①装置A中发生反应的化学方程式是
。
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是 浓溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量:
【方法一】称量反应前后A装置的总质量,计算出Fe2O3的含量;
【方法二】称量 得出反应生成的CO2的质量,计算出Fe2O3的含量。
(2)乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应(氧化铁与稀硫酸反应生成硫酸铁和水), (填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价。
| 方案 | 优点 |
| 甲组 | |
| 乙组 |
查看答案和解析>>
科目:初中化学 来源: 题型:
高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
(1)试管尾部放一团湿棉花的目的是 。
(2)探究生成的气体是什么? 用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是______________。写出该反应的化学方程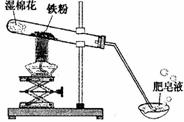 式 。
式 。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
| 与盐酸反应 | FeCl2+H2O | FeCl3+H2O | FeCl2+ FeCl3+H2O |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是 ;猜想二:剩余固体________。
【实验探究】(每空2分)
| 实验操作 | 实验现象及结论 |
【实验结论】铁和水蒸气反应的化学方程式为_______________________。
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。
(4)若反应前称得铁的质量为2.1g,高温下,铁与水反应结束称得固体质量为2.8 g则剩余固体成分是 。(通过计算说明,要求写出计算过程)
g则剩余固体成分是 。(通过计算说明,要求写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
铁是应用最广泛的金属。
(1) 为了检验铁生锈的条件,进行了如上图(略去其中的夹持装置)所示三个对比实验。
为了检验铁生锈的条件,进行了如上图(略去其中的夹持装置)所示三个对比实验。
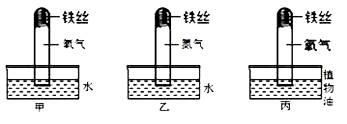
一段时间后,甲中铁丝发生锈蚀且 试管中液面上升,乙和丙中均无明显变
试管中液面上升,乙和丙中均无明显变 化。由此得出铁丝锈蚀的过程,实际上是铁丝与 、
化。由此得出铁丝锈蚀的过程,实际上是铁丝与 、  发生化学反应的过程;
发生化学反应的过程;
(2)铁制品在下列情况:①潮湿空气中②部分浸入食盐水中③干燥的空气中,最易生锈的是 (填序号,下同),不易生锈的是 ;
(3)在“南海一号”打捞出来的文物中,铁器锈迹斑斑,残存很少,请你列举出一种日常生活中常用的防止铁生锈的方法 。
查看答案和解析>>
科目:初中化学 来源: 题型:
小明发现家中一枚戒指生满了铜绿,他和同学利用这枚戒指展开了研究性学习。
【查阅资料】真金在空气中不会生锈,生满铜绿的“金戒指”材质为铜锌合金;铜长期露置在潮湿的空气中能生成铜绿,其主要成分是碱式碳酸铜,碱式碳酸铜受热易分解生成CuO、H2O和CO2。据上述资料可推知,碱式碳酸铜由__________种元素组成。
【实验探究】将该枚戒指加入过量稀盐酸中,有气泡产生,溶液由无色逐渐变为蓝绿色。
⑴小明认为:气体 中除了含有CO2,还可能含有少量__________。实验室常用__________的方法检验这种可能含有的气体。
中除了含有CO2,还可能含有少量__________。实验室常用__________的方法检验这种可能含有的气体。
⑵小红认为蓝绿色溶液中的溶质只有氯化锌。小华认为溶液中的溶质除了氯化锌外,还应该含有____________________。他取适量上述蓝绿色溶液,加入光亮的铁片,观察到了观察:①______________________________,②______________________________,证实了自己的观点。
⑶小娟取适量新制的FeCl2溶液,加入锌粒,一段时间后,溶液颜色变浅。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
某同学需测定某100g过氧化氢溶液中所含过氧化氢的质量.他取10g二氧化锰放入烧杯中,并将该过氧化氢溶液全部加入,不同时间用电子天平测量其质量,所得读数如表所示:
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯及所盛物质总质量/g | 335.70 | 334.30 | 334.00 | 333.50 | 333.00 | 332.50 | 332.50 |
(1)试分析,100g过氧化氢溶液完全反应后生成氧气的质量为 .
(2)计算100g过氧化氢溶液中过氧化氢质量分数为多少?(写出计算过程)
(3)请分析该方法测定结果可能会偏大的原因有 (写出一点即可).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com