
分析 根据金属活动性由强到弱的关系(Zn>Cu>Ag),锌可置换硝酸银中的银、锌可置换硝酸铜中的铜,生成的铜还可以置换硝酸银中的银,依据题中的现象进行分析.
解答 解:向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,发生的反应有锌可置换硝酸银中的银、锌可置换硝酸铜中的铜,生成的铜还可以置换硝酸银中的银,
(1)若滤液呈无色,所以溶液中一定不含硝酸铜,也不含硝酸银,则滤渣中一定含有的物质Cu、Ag;
(2)若向滤渣中滴加稀盐酸,无明显现象,说明锌没有剩余,锌可能置换出了部分银,也可能换出了全部银,也可能既换出了银,也换出了铜,所以滤液中所含溶质的成分可能有硝酸锌、硝酸银、硝酸铜,硝酸锌、硝酸铜,硝酸锌三种情况.
故答案为:(1)Cu、Ag;
(2)3.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.


科目:初中化学 来源: 题型:实验探究题
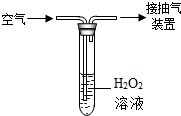 我国空气环境质量标准中,对空气中二氧化硫的浓度标准如表所示.
我国空气环境质量标准中,对空气中二氧化硫的浓度标准如表所示.| 标准 | 一级标准 | 二级标准 | 三级标准 |
| 单位体积空气中SO2的质量(mg/m3) | 0~0.15 | 0.15~0.50 | 0.50~0.70 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 明矾可以净水 | |
| B. | 双氧水制氧气加入二氧化锰后反应速率加快,是由于二氧化锰有催化作用 | |
| C. | 沾满油污的餐具用洗涤剂清洗,是利用洗涤剂的乳化功能 | |
| D. | 饱和溶液的溶质质量分数一定比不饱和溶液的溶质质量分数大 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:推断题
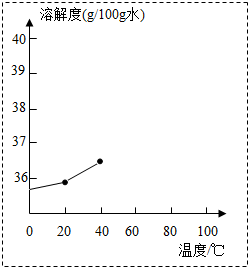 氯化钠与硝酸钾的部分溶解度如表(单位:g/100g水).
氯化钠与硝酸钾的部分溶解度如表(单位:g/100g水).| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 氯化钠 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| 硝酸钾 | 31.6 | 63.9 | 110 | 169 | 246 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| (1)称取上述固体样品8g溶于100mL水配成溶液,向溶液中滴加过量的氯化钙溶液充分反应后,静置. | 产生白色沉淀① | 说明久置固体中,一定含有Na2CO3 |
| (2)用玻璃棒蘸取少量①中的上层清液滴在pH试纸上,与标准比色卡对比,测出pH | pH=10 | 说明固体中,还一定含有 ②NaOH(填化学式). |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com