
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
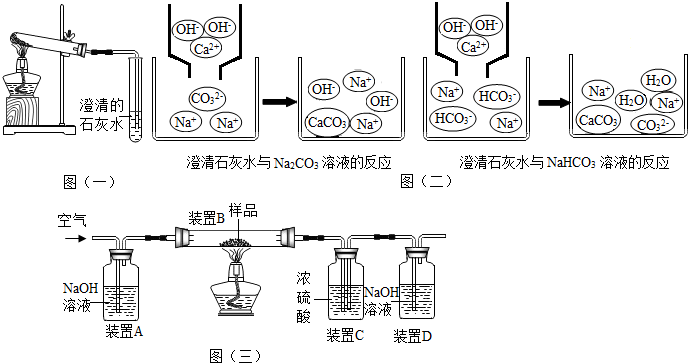
| 装置B | 装置C | 装置D | |
| 实验前物质的质量/g | 180.0 | 200.0 | 122.2 |
| 实验后物质的质量/g | 176.9 | 201.5 | 124.8 |
分析 【探究一】根据20℃时碳酸钠和碳酸氢钠的溶解度进行分析;
【问题讨论】根据碳酸钠和氢氧化钙反应会生成碳酸钙沉淀和氢氧化钠,碳酸氢钠和氢氧化钙反应实质是碳酸氢根离子和氢氧根离子、钙离子反应生成碳酸钙沉淀和水进行分析;
【方案一】(1)根据碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳进行分析;
(2)根据加热至恒重可以使碳酸氢钠完全分解进行分析;
①根据浓硫酸有吸水性,洗气时应该是长进短出进行分析;
②根据二氧化碳和氢氧化钠反应生成碳酸钠和水进行分析;
【讨论分析】根据溶液中会挥发出水蒸气,导致测定结果偏大来分析,空气中含有二氧化碳来分析;根据实验数据来分析解答,固体减少的质量就是碳酸氢钠分解生成水和二氧化碳的总质量;
【数据处理】根据题中的数据,结合化学方程式进行计算;
【拓展应用】根据碳酸氢钠受热会分解生成碳酸钠、水和二氧化碳进行分析.
解答 解:【探究一】20℃时碳酸钠和碳酸氢钠的溶解度分别为21.5g和9.6g,那么在该温度下,10g水中最多溶解2.15g碳酸钠达到饱和,最多溶解0.96g碳酸氢钠达到饱和,因此可分别加入2g固体,充分搅拌后,若完全溶解则为碳酸钠,若不能完全溶解则为碳酸氢钠,故选:A;
【问题讨论】碳酸钠和氢氧化钙反应会生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,碳酸氢钠和氢氧化钙反应实质是碳酸氢根离子和氢氧根离子、钙离子反应生成碳酸钙沉淀和水;
【方案一】(1)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)加热至恒重可以使碳酸氢钠完全分解;
①浓硫酸有吸水性,洗气时应该是长进短出,所以装置C的作用是吸收水蒸气,装置C中一个明显的错误是:右侧导管伸入液面以下;
②空气经过装置A时,其中的二氧化碳与氢氧化钠反应生成碳酸钠和水,化学方程式为:2NaOH+CO2=Na2CO3+H2O,若没有此装置,则装置D增重偏大,认为生成的二氧化碳质量偏大,造成测定结果偏大;
【讨论分析】小张认为不能用C装置的质量变化来计算,其理由是:装置A中逸出的水蒸气会进入装置C中,改进方法是:在装置A、B之间增加一个浓硫酸的干燥装置,小王又认为用装置D的质量差会偏大而影响计算,应增加一个操作:连接D装置前,缓缓鼓入空气,目的是:排尽装置内的二氧化碳气体;
【数据处理】解:设其中含碳酸氢钠的质量为x
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
168 (18+44=62)
x 180.0g-176.9g=3.1g
$\frac{168}{x}$=$\frac{62}{3.1g}$
x=8.4g
NaHCO3和Na2CO3混合物中NaHCO3的质量分数为:$\frac{8.4g}{10g}$=84%.
答:NaHCO3和Na2CO3混合物中NaHCO3的质量分数为84%;
【拓展应用】碳酸氢钠受热会分解生成碳酸钠、水和二氧化碳,所以固体Na2CO3中混有少量NaHCO3,可通过加热方法除去.
故答案为:【探究一】A;
【问题讨论】(1)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;OH-、HCO3-、Ca2+
(2)Na2CO3+CaCl2=CaCO3↓+2NaCl,有无气泡产生;
【探究三】[方案一](1)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑(2)保证NaHCO 3 全部分解;[方案二]①除去水蒸气;右侧导管伸入液面以下;
②2NaOH+CO2=Na2CO3+H2O,偏大;
【讨论分析】装置A中逸出的水蒸气会进入装置C中;在装置A、B之间增加一个浓硫酸的干燥装置;连接D装置前,缓缓鼓入空气;排尽装置内的二氧化碳气体;
【数据处理】84%;
【拓展应用】加热.
点评 本题考查碳酸氢钠含量的测定实验,为高频考点,把握实验装置的作用及实验目的为解答的关键,侧重分析、计算及实验能力的综合考查,题目难度中等.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:初中化学 来源: 题型:选择题
| A. | 高温条件下木炭还原氧化铜:黑色固体逐渐变成光亮的铜 | |
| B. | 铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出大量的热,生成黑色固体 | |
| C. | 硫在空气中燃烧发出明亮的蓝色火焰,生成有刺激性气味的气体 | |
| D. | 铜片放入硝酸银溶液中:固体表面有银白色固体产生,溶液由蓝色逐渐变为无色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
 物质王国的“小朋友”在做游戏,五位“小朋友”手拉手围成一圈(如图所示),要求相邻的“小朋友”之间必须能互相“配合”(即必须能发生化学反应),他们才能将游戏进行下去.场外还有四位替补“队员”.下列有关说法不正确的是( )
物质王国的“小朋友”在做游戏,五位“小朋友”手拉手围成一圈(如图所示),要求相邻的“小朋友”之间必须能互相“配合”(即必须能发生化学反应),他们才能将游戏进行下去.场外还有四位替补“队员”.下列有关说法不正确的是( )| A. | 圈内相邻的“小朋友”之间均未能发生置换反应 | |
| B. | 五位“小朋友”中Ba(OH)2和Ca(OH)2两位小朋友的位置能互相调换 | |
| C. | 若“CO2”小朋友玩累了,可换上场外的“H2SO4” | |
| D. | 若“Ba(OH)2”小朋友玩累了,可换上场外的“KOH” |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
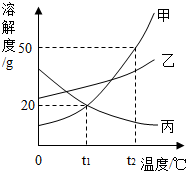 如图是甲、乙、丙三种物质的溶解度曲线,下列说法不正确的是( )
如图是甲、乙、丙三种物质的溶解度曲线,下列说法不正确的是( )| A. | t2℃时甲、乙、丙三种物质的溶解度由大到小的顺序是甲>乙>丙 | |
| B. | t2℃时,在100g水中加入60g甲,形成不饱和溶液 | |
| C. | 要从甲物质的饱和溶液中获得晶体甲,可采用降温结晶的方法 | |
| D. | 将丙物质的饱和溶液转化为不饱和溶液可以采用加水或降温的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 农业和园林灌溉,改大水浸灌为喷灌、滴灌 | |
| B. | 改进汽车发动机的燃烧方式,使汽油充分燃烧 | |
| C. | 为提高粮食产量,大量使用各种化肥、农药 | |
| D. | 回收利用废旧金属、废旧书籍及废弃废弃塑料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com