
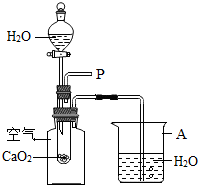
 小明在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小明共同探究.
小明在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小明共同探究.分析 根据已有的知识进行分析解答,鱼呼吸作用时需要氧气,足量的氧气是保证鱼存活的条件之一;在化学反应中遵循质量守恒定律,即反应前后元素的种类不变,原子的种类、个数不变;气体受热时体积膨胀,据此解答即可.
解答 解:(1)鱼塘中的鱼较多,呼吸作用时需要大量的氧气,向鱼塘中撒过氧化钙时,能和水反应生成氧气,供给鱼呼吸.
故填:向鱼塘中补充氧气.
(2)根据质量守恒定律,因反应物中含有氢元素,所以应有含有氢元素的生成物产生,氢氧化钙中含有氢元素,氧化钙中不含有氢元素,所以生成物除氧气外,还生成氢氧化钙.
故填:根据质量守恒定律,因反应物中含有氢元素,所以应有含有氢元素的生成物产生.
(3)烧杯中有气泡产生,说明反应是放热的,放出的热量使广口瓶中的温度升高,空气膨胀,从导管口逸出,产生气泡.
故填:CaO2与H2O的反应是放热反应.
点评 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.


科目:初中化学 来源: 题型:选择题
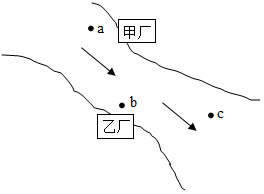 甲、乙两化工厂分布如图所示.箭头代表水流方向.如果在a处取得水样经检测只有少量OH-、SO42-.在c处取得水样经检测pH=7、且只含有少量NaCl.则b处水中含有的物质应是下列那一组?( )
甲、乙两化工厂分布如图所示.箭头代表水流方向.如果在a处取得水样经检测只有少量OH-、SO42-.在c处取得水样经检测pH=7、且只含有少量NaCl.则b处水中含有的物质应是下列那一组?( )| A. | BaCl2、HCl | B. | H2SO4、Ba(NO3)2 | C. | MgSO4、NaCl | D. | H2SO4、MgCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ②③④⑤ | C. | ①②③⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图所示,玻璃管中有色液体的左右移动可反映出瓶内气体温度的变化.当向盛有水的试管中加入少量的固体氢氧化钠时,发现有色液体向右移动,这说明氢氧化钠固体溶于水放热.而当向盛有水的试管中加入少量的硝酸铵时,发现有色液体向左移动,这又说明了硝酸铵固体溶于水吸热.
如图所示,玻璃管中有色液体的左右移动可反映出瓶内气体温度的变化.当向盛有水的试管中加入少量的固体氢氧化钠时,发现有色液体向右移动,这说明氢氧化钠固体溶于水放热.而当向盛有水的试管中加入少量的硝酸铵时,发现有色液体向左移动,这又说明了硝酸铵固体溶于水吸热.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验混合溶液 | A | B | C | D | E | F |
| 28%稀盐酸/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| HO/mL | V7 | V8 | V9 | V10 | 8 | 0 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 气体 | 反应前的药品状态 | 反应条件 | 气体性质 |
| 甲 | 固体+液体 | 常温 | 不与水反应,不易溶于水,密度比空气大 |
| 乙 | 固体+固体 | 加热 | 能与水发生反应,极易溶于水,密度比空气小 |
| 丙 | 固体+液体 | 加热 | 能与水发生反应,能溶于水,密度比空气大 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
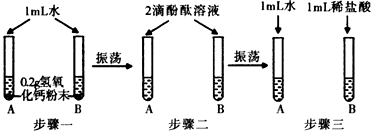
| 实验操作 | 实验现象 | 实验结论 |
| 取步骤三B试管中溶液样品倒入盛有锌粒的试管中 | 产生气泡 | 猜想一正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com