
【题目】某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如图操作流程:请回答:
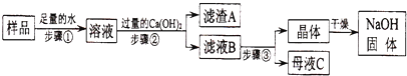
(1)步骤②反应的化学方程式为________;加入过量Ca(OH)2的目的是________
(2)滤液B中的溶质是________、________(写化学式);步骤③所包含的具体操作是加热浓缩、________、过滤.
(3)探究变质NaOH固体中碳酸钠的质量分数.
(设计实验)甲组同学:称取20.0g样品,放入足量的溶质质量分数为14.6%的稀盐酸直到反应停止,共收集到4.40g二氧化碳.
乙组同学:称取20.0g样品,加水配成溶液,向溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.0g.
(解决问题)
根据两组同学的实验结果,请你帮助他们计算出样品中碳酸钠的质量分数:________.(请写出计算过程 Ca:40 C:12O:16H:1Na:23)
(4)(交流与反思)
在交流时,老师问同学们“能否用上述实验所得的数据计算出样品中氢氧化钠的质量分数”,甲乙两组的同学都一致认为可以.但小明思考后,觉得甲、乙两种方案都不妥,理由是:________.
【答案】Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 将溶液中的碳酸钠完全转化为氢氧化钠 Ca(OH)2 NaOH 降温结晶 64.6% 因为样品中有水,无法测出样品的氢氧化钠的质量
【解析】
变质的氢氧化钠常会因氢氧化钠与二氧化碳反应含有碳酸钠,碳酸钠与氢氧化钙反应会生成碳酸钙与氢氧化钠,为把碳酸钠清除的更干净一些常会加入过量的氢氧化钙.
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;将溶液中的碳酸钠完全转化为氢氧化钠.
(2)由于溶液中加入了过量的氢氧化钙,所以滤液中会含有氢氧化钠与氢氧化钙,因为这两种物质的溶解度随温度的变化差异很大,故可采用降温结晶的方式进行分离.
故答案为:Ca(OH)2;NaOH;降温结晶;
[解决问题]
设样品中碳酸钠的质量为x,
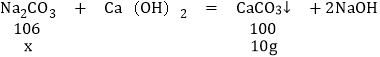
![]()
解得x=10.6g
所以:品中碳酸钠的质量分数![]()
[交流与反思]
因为样品中有水,无法测出样品的氢氧化钠的质量,所以以上数据不能计算出样品中氢氧化钠的质量分数,所以答案为:样品中有水,无法测出样品的氢氧化钠的质量.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:初中化学 来源: 题型:
【题目】某反应的微观示意图如下,用![]() 和
和![]() 代表A、B两种元素的原子,下列说法正确的是( )
代表A、B两种元素的原子,下列说法正确的是( )
![]()
A. 反应前后原子的种类不变
B. 该反应的基本类型为置换反应
C. 参加反应的物质的分子个数比为4:1
D. 该反应不符合质量守恒定律
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(一)铁材料的有关知识
(1)人类使用金属先后经历了“青铜”、“铁器”时代,到近代才开始大量使用铝材料.这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是_____.
(2)在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理_____.
(3)钢铁露置在空气中易生锈,写出一种防止钢铁生锈的方法_____.
以下是同学对铁锈的成分、铁锈制草酸亚铁晶体及草酸亚铁晶体热分解的研究.
(二)用上述铁锈制草酸亚铁晶体(FeC2O4·nH2O)
资料:①FeSO4遇到氧气氧化,会转化为Fe2(SO4)3.
②FeSO4的溶解度如下表:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
(制备流程)
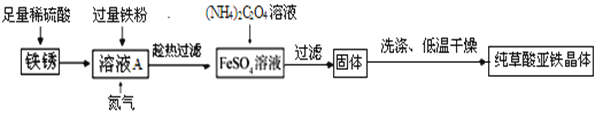
(1)溶液加入过量铁粉,发生的反应有:Fe+Fe2(SO4)3=3FeSO4、_____.充分反应后要趁热过滤的目的是_____.
(2)流程中产生草酸亚铁晶体反应的化学方程式为_____.
(3)制备过程中,溶液中通入氮气的作用是_____.
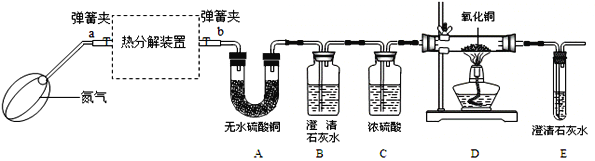
(三)探究FeC2O4·nH2O热分解的产物及n的值
(实验装置)
资料:①FeC2O4·nH2O为淡黄色粉末;FeO和Fe3O4都是黑色固体,其中FeO易被氧气氧化.
②FeC2O4·nH2O加热至300℃完全失去结晶水;继续加热至400℃,剩余固体受热分解产生黑色固体、CO2和CO.
(实验分析)
(1)若通过E装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解产生CO,则需在B和C装置之间增加盛有_____(填试剂名称)的洗气瓶.
(2)先鼓入氮气,再加热分解装置的原因是_____.
(3)指出上述实验装置不足之处_____.
(4)取3.60gFeC2O4·nH2O,按上述实验步骤进行实验,测得热分解装置中固体质量随温度变化曲线如下图所示:
①FeC2O4·nH2O中n的值为_____.
②反应后,热分解装置中残留的黑色物质为_____(填化学式).
③草酸亚铁晶体受热分解的方程式为_____.
④若将图中1.44g固体在空气中充分加热,固体增加0.16g,此固体(铁的氧化物)为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】多角度认识物质,能帮助我们更全面了解物质世界。以氧气、水和二氧化碳为例,回答下列问题:
(1)认识物质的结构
从微观角度上看,它们都是由__________(填“原子”、“ 分子”或“离子”)构成。
(2)认识物质的性质
①氧气的化学性质比较活泼。碳在氧气中充分燃烧生成二氧化碳,在氧气中不充分燃烧生成___________。(写化学式)
②如下图所示进行实验,观察到的现象是__________,产生该现象的原因为____________。(用化学方程式表示)。

(3)认识物质的用途
在偏远的山区,地下水是生活用水的主要来源,人们常用__________检验地下水是硬水还是软水;在生活中,常用__________的方法降低水的硬度,使硬水软化。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学用过氧化氢溶液和二氧化锰制取氧气,化学方程式为:2H2O2
2H2O +O2↑,该同学将50g过氧化氢溶液和1 g 二氧化锰混合,完全反应后,称量剩余的混合物质量为49.4g。
求:(1)反应产生氧气的质量是 g。
(2)该同学所用过氧化氢溶液的溶质质量分数是多少(列式计算)?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组用 X 气体与氧化铜反应制取铜的实验装置如图所示,请回答有关问题。
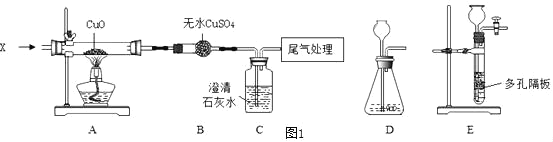
(1)实验开始时,先通一会儿 X 气体,再加热的目的是_____。
(2)实验进行一段时间后,A 玻璃管内观察到的黑色固体变红色,B 干燥管中无明显现象,C 中澄清石灰水变浑浊,则 X 气体为_____;写出 A 玻璃管内发生反应的化学方程式_____。
(3)若用氢气与氧化铜反应,则 B 干燥管中可观察到的现象是_____;用金属锌粒与稀硫酸反应制取氢气,你选择的实验装置(填编号)与理由是_____。
(4)实验过程中,X 气体和氧化铜反应不仅能生成铜,还可能生成中间产物氧化亚铜(化学式为 Cu2O)。如果要对反应后 A 处残留固体的组成进行探究,则残留固体可能的组成有_____种。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】盐酸是实验室常用的重要试剂,请回答下列问题:
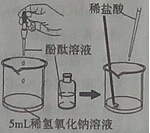
(1)为探究盐酸与氢氧化钠溶液的反应,设计下列实验方案:向5mL稀氢氧化钠溶液中滴加3滴酚酞溶液,然后逐滴加入稀盐酸,并用玻璃棒不断搅拌。
①实验过程中观察到的现象是 。
②向稀氢氧化钠溶液滴加稀盐酸至过量,溶液pH变化的曲线正确的是 (填写字母标号)。

(2)实验室可以利用稀盐酸等药品,通过连接下图装置制取二氧化碳、氢气。
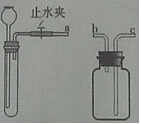
①制取二氧化碳气体装置的连接顺序是 (填写字母,下同),制取 氢装置的连接顺序是 。
②块状固体加入试管中的方法是 。
③检查发生装置气密性的方法是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具。请按要求用化学用语填空:
①2 个铜原子_____。
②5 个氢氧根离子_____。
③最理想、清洁能源的气体单质_____。
④氧化铝中铝元素的化合价为+3 价_____。
⑤一种通常用于改良酸性土壤的物质_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com