

分析 (1)根据题干信息来分析,天然水中一般都含有Ca2+、Mg2+、HCO3等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐、碱等混合物).
(2)根据氢氧化钙的化学性质分析解答;利用氢氧化钙能与可溶性碳酸盐生成不溶性的碳酸钙沉淀,可采取滴加碳酸钠溶液的方法检验清液中是否含有氢氧化钙;
(3)对于有气体生成或有气体参加的化学反应,在实验前就需要先检查装置的气密性;并结合碳酸盐的检验方法来分析;
气体质量不再增加,说明反应已经结束,干燥管增重的质量即为碳酸盐与稀盐酸反应生成二氧化碳气体的质量;
(4)根据水垢与稀盐酸反应生成的二氧化碳气体可能没有被碱石灰完全吸收来分析.
解答 解:(1)天然水中的三种主要离子可以结合成碳酸氢钙和碳酸氢镁两种主要物质,根据题干信息可知,在加热的条件下,得到溶解度更小的碳酸盐和碱的混合物,即:碳酸钙、碳酸镁、氢氧化镁、氢氧化钙等;故填:CaCO3;MgCO3;
(2)为检验氢氧化钙,取上层清液加入碳酸钠溶液,无白色沉淀出现,说明所取上层清液中不含氢氧化钙;故答案为:滴加Na2CO3溶液;
(3)①在向装置中加入药品进行实验前,要检查装置的气密性,以防装置漏气;利用碳酸盐可与稀盐酸完全反应放出二氧化碳,因此,所使用的酸应为稀动盐酸;
故答案为:前;稀盐酸;
②从图乙看出,第3.5分钟~第5分钟,干燥管内物质增加的质量都是16.5g,这说明水垢中的碳酸盐已完全参与了反应,增重的质量即为生成二氧化碳的质量.由题意可知,若水垢中的碳酸盐只有一种,可先假设该碳酸盐是碳酸钙,则设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 16.5g
$\frac{100}{44}=\frac{x}{16.5g}$
x=37.5g
则该水垢中含该种碳酸钙的质量分数为:$\frac{37.5g}{50g}×100%$=75%;
若假设该碳酸盐是碳酸镁,则设碳酸镁的质量为y
MgCO3+2HCl=MgCl2+H2O+CO2↑
84 44
y 16.5g
$\frac{84}{44}=\frac{y}{16.5g}$
y=31.5g
则该水垢中含该种碳酸镁的质量分数为:$\frac{31.5g}{50g}×100%$=63%
故答案为:水垢中的碳酸盐已完全参与了反应;75%或63%;
(4)若此方法时,少量的二氧化碳气体存在于装置内,没有完全被碱石灰吸收,因此计算结果偏小,所以应从导管A处缓缓鼓入一定量的空气,以保证生成的二氧化碳气体被完全吸收;故填:从导管A处缓缓鼓入一定量的空气.
点评 根据装置的特点及装置中所盛放药品的性质,对装置的作用进行理解,是解决给出实验装置类探究问题的一个重要手段.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:填空题
| 海水中含盐种类 | NaCl | CaCl2 | KCl | KBr | 其他 |
| 含盐的总质量 | 135.4亿吨 | 6.37亿吨 | 20亿吨 | 8.6亿吨 | 5.6亿吨 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 实验结论 | |
| A | 将一根未打磨的铝条放入 硫酸铜溶液中 | 无紫红色固体析出 | 铝不如铜活泼 |
| B | 将带火星的木条伸入氧气中 | 木条复燃 | 氧气支持燃烧 |
| C | 将CO通过灼热的氧化铜 | 黑色氧化铜变成红色 | CO具有可燃性 |
| D | 把浓硫酸滴入到氢氧化钠溶液中 | 溶液温度升高 | 中和反应放热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 反应后液体仍然为酸性 | |
| B. | “臭鸡蛋气味的气体”描述的是硫化氢的物理性质 | |
| C. | SO2与水反应生成亚硫酸,说明SO2与CO2有相似的化学性质 | |
| D. | 在上述过程中,溶液的质量和离子数量一直减小 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
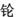 ,符号为Rg,该元素原子的核电荷数是111,Rg的相对原子质量为272,则中子数是161.
,符号为Rg,该元素原子的核电荷数是111,Rg的相对原子质量为272,则中子数是161.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com