
| A. | 节约资源,节能减排 | B. | 重复利用,循环再生 | ||
| C. | 低碳环保,绿色出行 | D. | 铺张浪费,相互攀比 |
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:初中化学 来源: 题型:解答题
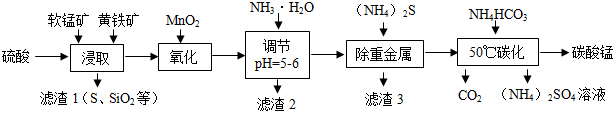
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 实验序号 | 温度(℃) | 大理石颗粒 | 盐酸质量分数(%) | 实验目的 |
| 1 | 20 | 粗 | 5 | 探究大理石和盐酸的反应速度与石灰石颗粒大小的关系 |
| 2 | 20 | 细 | 5 |
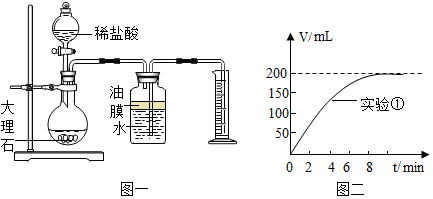
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 50克 | B. | 30克 | C. | 40 | D. | 40克 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com