
| 选项 | 物质 | 杂质(少量) | 试 剂 | 操作方法 |
| A | Cu | CuO | O2 | 加热 |
| B | 氯化钙溶液 | 盐酸 | 过量的碳酸钙 | 过滤 |
| C | 氯化钠 | 纯碱 | 适量的稀盐酸 | 溶解、过滤、蒸发 |
| D | H2O | 悬浮物 | 明矾 | 吸附 |


 全能闯关100分系列答案
全能闯关100分系列答案科目:初中化学 来源:不详 题型:实验题
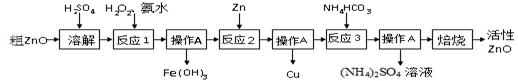
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去。 | ||||
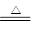 ZnO+CO2↑ Zn(OH)2
ZnO+CO2↑ Zn(OH)2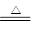 ZnO+H2O
ZnO+H2O 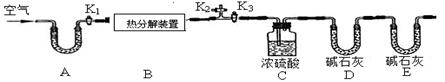
| | 装置C的质量(/g) | 装置D的质量(/g) |
| 实验前 | 198.4 | 235.7 |
| 实验后 | 209.2 | 244.5 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:推断题
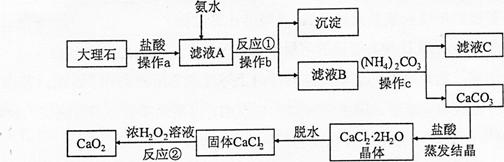
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.铵态氮肥与草木灰混合施用会降低肥效 |
| B.将98%的浓H2SO4稀释成49%的稀H2SO4,加入水的质量与浓硫酸质量一定相等 |
| C.NaOH和MgO的混合物中氧的质量分数为40%,则混合物中NaOH和MgO的质量比为任意值 |
| D.一定量的氯化钠溶液恒温蒸发5g水,析出a g晶体;再蒸发5g水,又析出b g 晶体,a与b一定相等 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
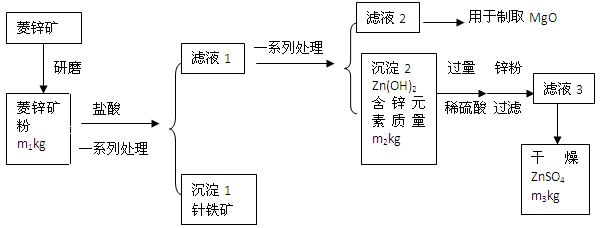
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.内壁有CaCO3的试管用稀盐酸清洗 | B.内壁有碘的试管用酒精清洗 |
| C.内壁有铜粉的试管用稀硫酸清洗 | D.内壁有植物油的试管用洗洁精清洗 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:推断题
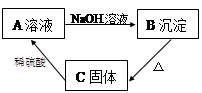
 B_____________________。
B_____________________。 A______________________。
A______________________。查看答案和解析>>
科目:初中化学 来源:不详 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com