
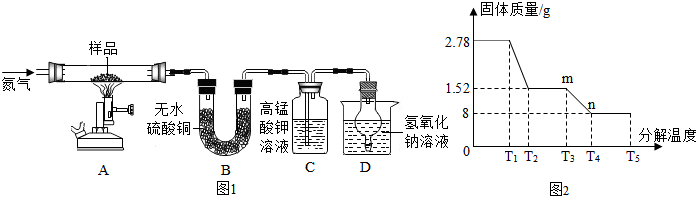
分析 探究一:为回收废水中的铜,可以使用活动性比铜活泼的金属比如铁将其置换出来;然后依据反应流程图分析所加入的金属和生成物,写出反应方程式;无水硫酸铜白色粉末遇水变蓝,故常用来检验水的存在,二氧化硫能使高锰酸钾溶液褪色;根据反应前后元素的种类不变及红棕色固体可与稀盐酸反应生成黄色溶液分析解答;硫酸亚铁分解生成的二氧化硫能造成空气污染,可以使用氢氧化钠溶液将其除去.
探究二:根据反应的化学方程式结合题干提供的数据进行解答.
解答 解:【探究一】
(1)无水硫酸铜白色粉末遇水变蓝,生成的水的质量为:27.8g-15.2g=12.6g;C中高锰酸钾溶液褪色,所以根据题意可知,硫酸亚铁晶体能分解生成二氧化硫;
氧化铁能与盐酸反应生成氯化铁和水,故答案为:水;12.6g;SO2;Fe2O3+6HCl=2FeCl3+3H2O.
(2)把球形干燥管插入氢氧化钠溶液中的作用是防止液体倒吸,反应生成的二氧化硫是空气污染气体,可以使用氢氧化钠溶液将其吸收;
故答案为:防止NaOH溶液倒吸.
(3)硫酸亚铁晶体分解生成氧化铁、二氧化硫和三氧化硫,故答案为:2FeSO4=Fe2O3+SO2↑+SO3↑;
(4)硫酸亚铁的质量为15.2g,水的质量为12.6g
FeSO4--xH2O
152 18x
15.2g 12.6g
$\frac{152}{18x}=\frac{15.2g}{126g}$
x=7
故答案为:7;
【交流讨论】实验中要持续通入氮气,否则是的质量偏小,测出的x会偏小,故答案为:偏小;
【探究二】
①取10g补血剂样品研细后溶于40g水中,研细的目的是增大接触面积,使其充分溶解,故填:增大接触面积,使其充分溶解;
②向所配制的溶液中加氯化钡溶液至略过量,使其充分反应;
③过滤,洗涤,干燥,称量所得白色固体的质量为6.99g.
请计算出10g样品中FeSO4的质量分数,写出计算过程.设硫酸亚铁的质量为x
FeSO4+BaCl2=BaSO4↓+FeCl2
152 233
x 6.99g
$\frac{152}{233}=\frac{x}{6.99g}$
x=4.56g
硫酸亚铁的质量分数为:$\frac{4.56g}{10g}×100%$=45.6%
故答案为:45.6%.
点评 本题是一道实验探究题,能较好的考查学生分析和解决问题的能力,考查了常见金属的性质以及某些盐的性质,解答时要依据题干提供信息,结合相关知识细心分析解答.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 滤液N中可能有单质铁,也可能有单质镁 | |
| B. | 滤液M中至少含有两种金属阳离子 | |
| C. | 滤渣N的质量一定小于加入铁粉的质量 | |
| D. | 滤液M的颜色和原溶液的颜色一样 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  点燃酒精灯 | B. |  检查气密性 | C. | 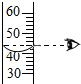 液体读数 | D. |  倾倒液体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只有② | B. | 只有②④ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com