
分析 (1)铁与稀硫酸反应会生成氢气,反应前后质量变化即为氢气的质量.根据氢气的质量求出铁的质量.
(2)根据氢气求出硫酸亚铁的质量,再利用杂质的质量求出溶液的质量,则问题可解决.
解答 解:(1)分析知反应前后的质量变化即为氢气的质量,利用氢气的质量可求出铁的质量,
产生氢气的质量=(5.8g+55.4g)-61g=0.2g
(2)设参与反应的铁的质量是x,设硫酸亚铁的质量是y
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.2g
$\frac{56}{x}=\frac{152}{y}=\frac{2}{0.2g}$
x=5.6g
y=15.2g
反应后所得溶液质量=5.6g+55.4g-0.2g=60.8g
反应后所得溶液中溶质的质量分数=$\frac{15.2g}{60.8g}×$100%=25%
答案:
(1)产生氢气的质量为0.2g,该铁合金样品中铁的质量为5.6g;
(2)反应后所得溶液中溶质的质量分数为25%.
点评 此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用反应前后物质质量的变化求出生成氢气的质量,而后根据它的质量求出其它的需要的物质的质量解答即可.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 6:3:2 | D. | 117:222:267 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KOH、KCl、H2SO4 | B. | H2SO4、KOH、KCl | C. | KOH、H2SO4、KCl | D. | KCl、KOH、H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
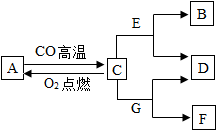 现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如图所示关系,请回答下列问题.
现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如图所示关系,请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 酸、碱和盐是初中阶段化学学习的重要内容,根据它们相互间的反应现象进行合理推断更是同学们必须具备的综合能力,飞飞同学的具体实验操作流程示意图如下:
酸、碱和盐是初中阶段化学学习的重要内容,根据它们相互间的反应现象进行合理推断更是同学们必须具备的综合能力,飞飞同学的具体实验操作流程示意图如下:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
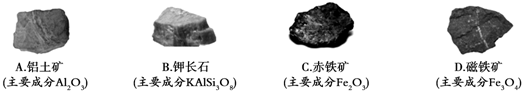
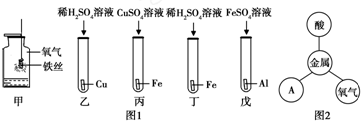

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 图为“XX”钙片商品标签图,请根据标签的有关信息完成下列各题:
图为“XX”钙片商品标签图,请根据标签的有关信息完成下列各题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com