
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,从中获取的信息正确的是
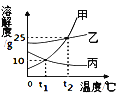
A. 蒸发溶剂可使丙的饱和溶液变为不饱和溶液
B. 将t1℃55g甲的饱和溶液升温至t2℃时的饱和溶液,需加甲的质量为7.5g
C. t1℃时,等质量的甲、乙、丙三种溶液所含溶质的质量可能相同
D. t2℃时,甲、乙、丙的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数大小顺序为乙>甲=丙
【答案】BC
【解析】
A、蒸发溶剂可使丙的不饱和溶液变为饱和溶液,故A错误;
B、t1℃时,甲的溶解度为10g,根据溶解度概念可知,55g饱和溶液中存在50g的水和5g甲,升温至t2℃时,溶液中的水仍为50g,t2℃时,甲的溶解度为25g,根据溶解度概念可知,50g的水中溶解12.5g甲达到饱和,将t1℃55g甲的饱和溶液升温至t2℃时的饱和溶液,需加甲的质量=12.5g-5g=7.5g,故B正确;
C、t1℃时,乙的溶解度最大,甲、丙物质的溶解度相等,甲、丙物质配成饱和溶液,乙物质配成不饱和溶液,质量分数可能相等,所以等质量的甲、乙、丙三种溶液所含溶质的质量可能相同,故C正确;
D、将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,甲、乙的溶解度减小,丙的溶解度随温度的降低而增大,甲、乙有晶体析出,质量分数变小,溶液仍为饱和溶液,丙没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=![]() ,溶解度越大,质量分数越大,t1℃时乙的溶解度大于甲的溶解度大于t2℃时丙的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是乙>甲>丙,故D错误。故选BC。
,溶解度越大,质量分数越大,t1℃时乙的溶解度大于甲的溶解度大于t2℃时丙的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是乙>甲>丙,故D错误。故选BC。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】下列装置常用于实验室制取气体.
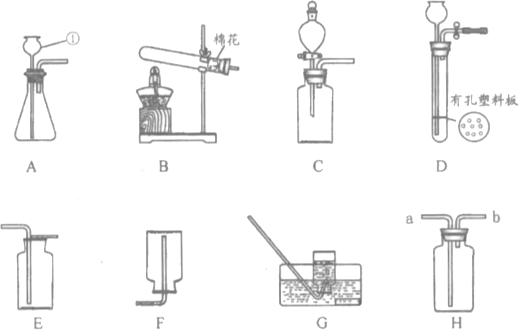
(1)写出上图中指定仪器的名称:①______________。
(2)用高锰酸钾制取并收集纯度相对较大的氧气,可以选择的装置是________(填字母)。该反应的化学方程式为____________________________,属于________(填基本反应类型)反应。
(3)制取二氧化碳时,如需控制产生气体的速率,发生装置最好选用____________(填字母),使用装置H进行排空气法收集二氧化碳,气体应从________(选填“a”或“b”)端通入。
(4)实验室制取硫化氢气体的原理:室温下,块状不溶性的硫化亚铁(FeS)固体与稀硫酸反应(另一产物为硫酸亚铁)。
①写出该反应的化学方程式:___________________。
②若想控制反应的发生和停止,可选用的发生装置为______________(填字母)。
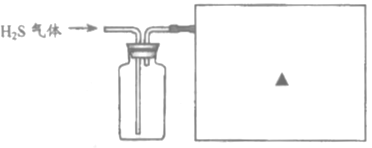
③已知硫化氢气体有毒,密度比空气大,能溶于水且易与NaOH溶液反应。请在下图方框内补充完整收集硫化氢气体的装置图。_______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明、小红为了探究实验室中久置的氢氧化钠固体的成分(假设不含水),进行了有关实验。
(对固体成分猜想)
小明、小红两同学根据氢氧化钠的化学性质,提出了三种猜想:
猜想I:全部是NaOH;猜想Ⅱ:______;猜想Ⅲ:是NaOH和Na2CO3混合物。

(实验和推断)
(1)请你完成猜想Ⅱ:_______。
(2)若A是CaCl2溶液,当实验现象a为_______,现象b为_______,则猜想Ⅱ成立。
(3)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为_______(填化学式),该实验_____(填“能”或“不能”)说明样品中有NaOH。
(4)若现象a为有气泡产生,则加入的A溶液是________(填化学式),说明氢氧化钠已经变质,产生气泡的原因(用化学方程式表示):______。
(5)利用下图装置,小明认为称出样品的质量、装置H在反应前后的质量,再利用化学反应方程式可算出样品中碳酸钠的质量分数。而小红同学认为小明测出的值可能有较大的误差,从装置角度考虑造成误差的主要原因是:________。

(反思)
久置的氢氧化钠变质的原因是(用化学方程式表示):_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属加工工业排放的废水中含有NaNO2、NaOH,可加入铝粉加热除去.
(1)NaNO2中氮元素的化合价为_____.
(2)除去时,生成NaAlO2和能使湿润红色石蕊试纸变蓝的气体,反应的化学方程式为_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某方便面的营养成分表如表(其中碳水化合物主要指淀粉等):
营养成分表 |
项目每100克 |
能量 1966千焦 蛋白质 7.5克 脂肪 21.8克 碳水化合物 60.7克 钠 2300毫克 |
(1)表中“钠”是指_____(填字母序号)。
A 离子B 分子 C 元素D 单质
(2)该方便面中含的营养素有_____种。
(3)方便面中使用的食盐可以是加碘盐,人体中缺碘可能患有的疾病是_____(填“甲状腺肿大”或“骨质疏松”)。
(4)方便面通常采用精美的塑料袋包装,处理不当易造成“白色污染”,塑料属于_____材料。
(5)中国居民膳食指南建议每天食用食盐石超过6克,假设小明某天吃了100克该方便面,相当于吃了食盐_____克。(保留小数点后一位)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组欲用4.9%的稀H2SO4,测定一瓶标签破损的NaOH溶液的溶质质量分数。
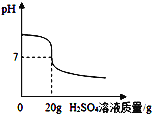
⑴欲配制200g4.9%的稀硫酸溶液,需用98%的浓硫酸_______g。
⑵取10gNaOH溶液样品与4.9%的稀硫酸溶液混合,溶液中pH变化如图所示。当加入稀硫酸质量小于20g时,混合溶液中的溶质为____(填化学式)。
⑶求NaOH溶液样品中溶质的质量分数____?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】四十九中潜能实验小组想通过某工厂煅烧一段时间之后的石灰石来判断原石灰石样品的纯度(样品中杂质不溶于水,也不和酸反应),进行了如下实验,记录数据如下:
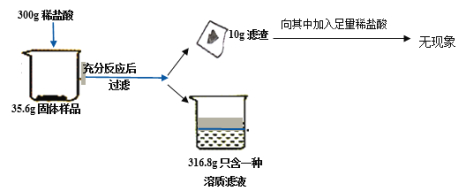
试回答下列问题:
(1)实验过程中产生明显现象的化学方程为___________.
(2)上述实验过程中产生气体的质量为___________
(3)根据气体的质量列出参加反应物质质量 (X)的比例式_________.
(4)若将最终滤液蒸发16.8g水,所得溶液中溶质的质量分数为________.
(5)若配制上述实验所用的稀盐酸200g,需要质量分数为36.5%浓盐酸的质量是_____
(6)原石灰石样品的纯度(主要成分的质量分数)为______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习小组测定某工业废水(含有H2SO4、HNO3,不含固体杂质)中H2SO4的含量。取100g废水于烧杯中,加入100gBaCl2溶液,恰好完全反应,经过滤得到176.7g溶液。
(可溶性杂质不参加反应,过滤后滤液的损失忽略不计)
(1)充分反应后生成沉淀的质量为_______g;
(2)该工业度水中硫酸的质量分数为多少?(写出计算过程)
(3)为避免工业废水污染环境,排放前应对废水进行中和处理,需加入的物质是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图所示装置回答问题:

(1)写出下列仪器的名称:①______,②______。
(2)用石灰石和稀盐酸制取少量二氧化碳且能控制反应随时发生或停止,选择的发生装置是__,反应的化学方程式为______。若用G来收集二氧化碳,气体应该从____(选“a”或“b”)进入。
(3)用B装置制取二氧化碳,若B与下图中1的导管连接,则1中出现的现象是___,原因是___(用化学方程式表示)。若B与3的导管连接,则3中的现象是____
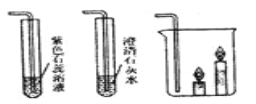
1 2 3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com