
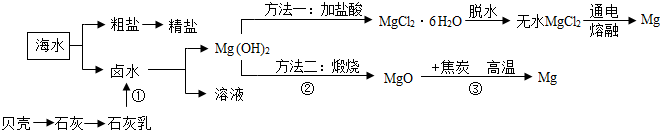
分析 (1)经过①、②两个步骤是将海水中的镁离子提取出来,富集镁离子;
(2)石灰乳显碱性,要想检验碱液是否过量关键是看溶液是否显碱性,用酚酞作指示剂检验即可;
(4)电解熔融氯化镁的过程中,电能转化为化学能;此反应需要在特殊的真空环境下进行,这样做的目的是防止生成的镁被空气中氧气氧化;
(5)根据氧化镁和焦炭在高温条件下生成金属镁和二氧化碳进行解答;
(6)根据镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;
解答 解:(1)海水或卤水均含有氯化镁,氯化镁溶解在海水中,不能直接提取出来,经过①、②两个步骤将海水中的镁离子提取出来,得到纯净的氯化镁,然后电解才能得到镁;
(2)要想检验碱液是否过量关键是看反应后溶液是否显碱性,用酚酞作指示剂检验,如果酚酞变红则碱液过量;
(4)电解熔融氯化镁的过程中,电能转化为化学能;此反应需要在特殊的真空环境下进行,这样做的目的是防止生成的镁被空气中氧气氧化;
(5)氧化镁和焦炭在高温条件下生成金属镁和二氧化碳,化学方程式为2MgO+C$\frac{\underline{\;高温\;}}{\;}$2Mg+CO2↑;
(6)先将粗盐①溶解;⑤加过量NaOH溶液除去镁离子;③加过量的BaCl2溶液除去硫酸根离子;②加过量的Na2CO3溶液加入适量的碳酸钠可以除去钙离子和反应剩余的氯化钡;⑦过滤除去沉淀和泥沙;④加适量的盐酸加入适量的盐酸可以除去反应剩余的氢氧化钠和碳酸钠;⑥蒸发结晶得到精盐,所以正确的操作顺序是①⑤③②⑦④⑥;
故答案为:
(1)富集MgCl2,得出纯净的MgCl2;(2)MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;(3)向反应后物质中滴加无色酚酞试液,无色酚酞试液变红色,说明石灰乳过量;(4)电;化学;防止生成的镁被空气中氧气氧化;(5)2MgO+C$\frac{\underline{\;高温\;}}{\;}$2Mg+CO2↑;(6)①⑤③②⑦④⑥;
点评 解答本题要掌握化学方程式的书写方法和从海水中提炼金属镁的过程,一定要按照步骤规范准确的书写化学方程式.


科目:初中化学 来源: 题型:解答题
| 地 块 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 施肥情况(等质量) | 尿素 (含N) | 磷酸二氢钾 (含P、K) | 磷酸二氢铵 (含N、P) | 硫酸铵 (含N) | 不施肥 |
| 小麦收获量(千克) | 55.56 | 69.26 | 56.88 | 55.44 | 55.11 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 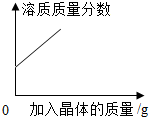 某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体 | |
| B. | 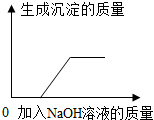 向硫酸铜溶液中加入过量的氢氧化钠溶液 | |
| C. | 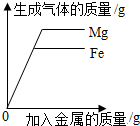 向足量且溶质质量分数相等的稀硫酸中分别加入等质量的金属镁和铁 | |
| D. | 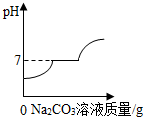 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量碳酸钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质使用与安全常识 | |
| B. | 环境保护与物质使用 | |
| C. | 元素与物质的组成 | |
| D. | 微观粒子与物质的构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
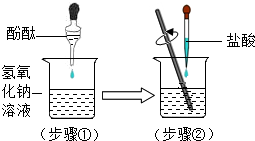 某兴趣小组用图示装置做酸碱中和反应实验,试回答:
某兴趣小组用图示装置做酸碱中和反应实验,试回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度/g | 36.0 | 36.6 | 37.3 | 38.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在汽油中添加一定比例的乙醇 | B. | 大力发展太阳能产业 | ||
| C. | 使用简易布袋代替塑料购物袋 | D. | 用性质稳定的氟利昂作致冷剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com