解:(1)不溶于液体的固体和液体分离的方法是过滤,所以操作④是过滤;由于氯化钠的溶解度受温度影响不大,所以从溶液中结晶析出的方法是蒸发溶剂;
(2)设粗盐样品中氯化钙的质量为x,生成的NaCl质量为y,则
Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl
111 100 117
x 2.0g y
根据:

解得X=2.22g,根据:

解得Y=2.34g.
(1)粗盐样品中氯化钙的质量分数=
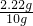
×100%═22.2%
(2)原混合物中的氯化钠的质量为10g-2.22g,滤液中的氯化钠的质量为10g-2.22g加上生成的氯化钠2.34g,所以为10g-2.22g+2.34g.而溶液的总质量反应前的总质量除了生成沉淀2.0g以外,其余均在溶液.而反应前的总质量为10g+100g+21.2g,后生成沉淀质量为2.0g,所以得到的溶液的质量为10g+100g+21.2g-2.0g
滤液的溶质质量分数=

×100%═7.8%
答:粗盐样品中氯化钙的质量分数22.2%;滤液的溶质质量分数7.8%.
故答案为:(1)过滤;蒸发溶剂;(2)①22.2%;②7.8%
分析:(1)根据不溶于液体的固体和液体分离的方法考虑,根据精盐从溶液中析出的方法考虑;(2)①欲求该粗盐样品中氯化钙的质量分数,须先根据化学方程式求出样品中氯化钙的质量,再利用质量分数公式计算即可.②欲求所的滤液的溶质质量分数,须先根据化学方程式求出溶质的质量,再根据溶质质量分数=
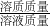
×100%计算即可;此题需根据质量守恒定律求得滤液质量.
点评:本题主要考查学生对物质质量分数和溶质质量分数的计算能力.学生需正确书写出化学方程式,然后根据化学方程式找出比例关系,列出比例式,并正确分析各物质之间的关系,才能正确答题.


 解得X=2.22g,根据:
解得X=2.22g,根据: 解得Y=2.34g.
解得Y=2.34g.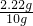 ×100%═22.2%
×100%═22.2% ×100%═7.8%
×100%═7.8%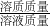 ×100%计算即可;此题需根据质量守恒定律求得滤液质量.
×100%计算即可;此题需根据质量守恒定律求得滤液质量.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案