
将
4.6g某化合物放入氧气中完全燃烧,生成8.8g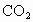 和5.4g
和5.4g .问:这种化合物里含有哪几种元素?4.6g该化合物中各元素的质量分别是多少?
.问:这种化合物里含有哪几种元素?4.6g该化合物中各元素的质量分别是多少? |
4.6g 该化合物中含C、H元素的质量分别为:碳: 8.8g×12÷44=2.4g氢: 5.4g×2÷18=0.6g显然 4.6g>(2.4+0.6)g,根据质量守恒定律可知,该化合物还含有氧元素,其质量为:4.6g-2.4g-0.6g=1.6g因此,该化合物中含有 C、H、O三种元素,4.6g该化合物中各元素的质量分别为2.4g、0.6g、1.6g.本题属于根据已知的生成物的质量求反应物元素种类和质量的问题.由质量守恒定律可知,该化合物中肯定含有 C、H两种元素,且与生成的 和 和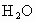 中所含的C、H两种元素的质量相等.这样,便可,迅速算出4.6g该化合物中C、H元素的质量,然后再与该化合物的总质量相比,即可知是否含有O元素,并计算出其质量. 中所含的C、H两种元素的质量相等.这样,便可,迅速算出4.6g该化合物中C、H元素的质量,然后再与该化合物的总质量相比,即可知是否含有O元素,并计算出其质量. |


科目:初中化学 来源:课堂三级讲练化学 九年级(上) 题型:038
将4.6g某化合物放入氧气中完全燃烧,生成8.8g二氧化碳和5.4g水,问:这种化合物含有哪几种元素?4.6g该化合物中各元素的质量分别是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com