
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放入试管中,滴加一定量的 | 试管中固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊. | 固体中一定含有 不含Fe2O3. |
| 取少量固体放入试管中,加水溶解,静置后取上层清液滴加无色酚酞溶液. | 试管底部有不溶物, | 固体中含有氧化钙和氢氧化钙. |


科目:初中化学 来源: 题型:
| A、X、Mg、Cu |
| B、Cu.X.Mg |
| C、Mg、Cu、X |
| D、Mg.X.Cu |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 1 | 2 | 3 | 4 | |
| 样品质量/g | 25 | 25 | 25 | 30 |
| 稀硫酸质量/g | 80 | 100 | 120 | 100 |
| 产生气体质量/g | 0.4 | 0.5 | 0.5 | 0.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 新药帕拉米韦注射液可用于治疗H7N9禽流感,其说明书中部分内容如图.
新药帕拉米韦注射液可用于治疗H7N9禽流感,其说明书中部分内容如图.查看答案和解析>>
科目:初中化学 来源: 题型:
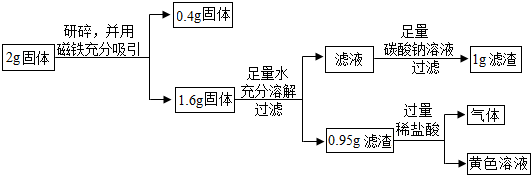
查看答案和解析>>
科目:初中化学 来源: 题型:
| 纯牛奶 配料:鲜牛奶 保质朗:8个月 净含量:250mL/盒 营养成分:(每100mL) 钙≥0.11g 脂肪≥3.3g 蛋白质≥2.9g |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com