
| A. | 生铁和钢的性能不同--含碳量不同 | |
| B. | CO和C02的化学性质不同--分子构成不同 | |
| C. | 钠原子和钠离子化学性质不同--质子数不同 | |
| D. | 金刚石和石墨的物理性质不同--原子排列方式不同 |
分析 A.根据生铁和钢都是铁的合金进行解答;
B.根据二氧化碳和一氧化碳的分子构成不同来分析;
C.根据钠原子失去1个电子形成钠离子来分析;
D.根据结构决定性质来分析.
解答 解:A.生铁和钢的性能不同是因为含碳量不同,生铁的含碳量为2%~4.3%,钢中的含碳量为0.03%~2%,故A正确;
B.CO和CO2的性质不同,是由于构成它们的分子不同,说法正确,故B正确;
C.钠原子失去1个电子形成钠离子,钠原子和钠离子化学性质不同是由于其最外层电子数不同,故C错误;
D.金刚石和石墨的物理性质不同,是由于其碳原子排列组成不同,故D正确.
故选C.
点评 本题知识点较多但难度不大,平时要注意基础知识的积累.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
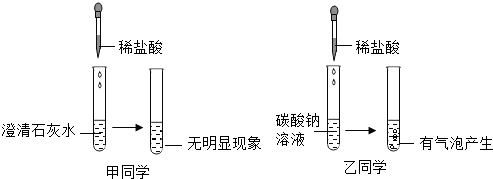
 兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:
兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:| 实验操作 | 实验现象 | |
| 甲同学 | 在盛有10mL一定浓度的氢氧化钠溶液的烧杯中,用胶头滴管慢慢滴入1-2滴稀硫酸,振荡,同时测定溶液的pH | 溶液pH减小但仍大于7 |
| 乙同学 | 在盛有10 mL一定浓度的氢氧化钠溶液的烧杯中,先滴入几滴无色酚酞溶液,然后再加入稀硫酸 | 溶液由红色变为无色 |
| 实验步骤 | 实验现象 | 结论 |
| 取少量碳酸钠固体于试管中滴加乙同学上述反应后的溶液于试管中 | 若有气泡生成 | 稀硫酸过量(“过量”或“不过量” |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
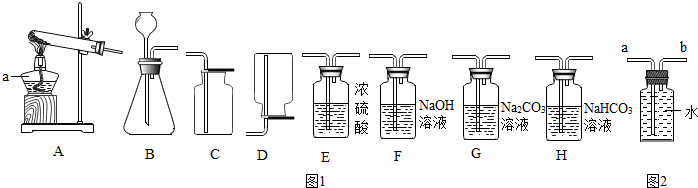
| 药品实验编号 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
| 实验步骤 | 实验现象 | 实验结论 |
| 将生成的气体通入AgNO3溶液中 | 产生白色沉淀 | 气体中有HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂所用试剂和方法 |
| A | CaCl2溶液 | 稀HCl | 加入过量的碳酸钙,过滤 |
| B | NaOH溶液 | Ca(OH)2溶液 | 先加入过量Na2CO3溶液,再过滤 |
| C | CO2 | HCl气体 | 先通过NaOH溶液,再通过浓硫酸 |
| D | CaO | CaCO3 | 加入适量的蒸馏水,过滤,蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com