
某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是( )
A.Zn B.Cu C.Mg D.Ag
C
【解析】
试题分析:铜、银不能和稀硫酸反应;
解:设5.6g铁与足量的稀硫酸充分反应生成氢气的质量为X,
Fe+H2SO4═FeSO4+H2↑
56 2
5.6g X
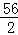 =
=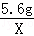
X=0.2g;
解:设5.6g锌与足量的稀硫酸充分反应生成氢气的质量为Y,
Zn+H2SO4═ZnSO4+H2↑
65 2
5.6g Y
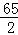 =
=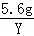
Y=0.17g,
解:设5.6g镁与足量的稀硫酸充分反应生成氢气的质量为Z,
Mg+H2SO4═MgSO4+H2↑
24 2
5.6g Z
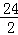 =
=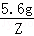
Z=0.47g,
由以上计算可知,当5.6g纯铁与足量稀硫酸反应时能够生成0.2g氢气,
当5.6g纯锌与足量稀硫酸反应时能够生成0.17g氢气,
当5.6g纯镁与足量稀硫酸反应时能够生成0.47g氢气,
由此可知,不纯的铁5.6g中,如果含有锌,则生成的氢气小于0.2g,如果含有镁,则生成的氢气大于0.2g,
不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是镁.
故选:C.
考点:根据化学反应方程式的计算.
点评:解答本题要注意临界点,即以5.6g为纯铁时为基础,计算出生成氢气的质量,然后再通过计算判断出杂质是什么物质.


科目:初中化学 来源:2013年四川省达州市中考化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com