
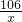 =
=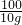
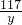 =
=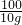
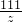 =
=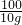
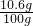 ×100%=10.6%
×100%=10.6%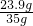 ×100%=68.3%.
×100%=68.3%. ×100%=12.8%
×100%=12.8%

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?普陀区二模)某天然盐碱湖泊中得到的碳酸钠产品中混有少量氯化钠.用如图装置对产品进行碳酸钠的含量分析.(已知:HCl+NaHCO3→NaCl+CO2↑+H2O;CO2在饱和NaHCO3溶液中溶解度很小)有关实验操作说法正确的是( )
(2013?普陀区二模)某天然盐碱湖泊中得到的碳酸钠产品中混有少量氯化钠.用如图装置对产品进行碳酸钠的含量分析.(已知:HCl+NaHCO3→NaCl+CO2↑+H2O;CO2在饱和NaHCO3溶液中溶解度很小)有关实验操作说法正确的是( )查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:2013年4月中考化学模拟试卷(53)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com