向40克已知过量的氢氧化钡溶液中,加入25%的硫酸钠溶液28.4克,反应完全后,过滤沉淀;再滴加30毫升20%的稀硫酸(密度为1.147克/厘米3)恰好使滤液呈中性.求原氢氧化钡溶液的溶质质量分数.
分析:原氢氧化钡溶液的溶质质量分数=
×100%,因此,需要计算出40g氢氧化钡溶液中氢氧化钡的质量;
40g氢氧化钡溶液中的氢氧化钡部分与硫酸钠,然后剩余的氢氧化钡及生成的氢氧化钠再硫酸恰好完全反应,因此,可通过两次反应的化学方程式计算出氢氧化钡的质量.
解答:解:设25%的硫酸钠溶液28.4克完全反应消耗氢氧化钡的质量为x,生成NaOH质量为y
28.4g25%的硫酸钠溶液中Na
2SO
4的质量=28.4g×25%=7.1g
Na
2SO
4+Ba(OH)
2=BaSO
4↓+2NaOH
142 171 80
7.1g x y
= 解之得x=8.55g
= 解之得y=4g
设4gNaOH消耗硫酸的质量为z
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 98
4g z
= 解之得z=4.9g
则所滴加的硫酸中与氢氧化钡反应的质量=30mL×1.147g/cm
3×20%-4.9g=1.982g
设与硫酸恰好完全反应的氢氧化钡质量为w
H
2SO
4+Ba(OH)
2=BaSO
4↓+2H
2O
98 171
1.982g w
= 解之得w≈3.46g
原氢氧化钡溶液的溶质质量分数=
×100%≈30%
答:原氢氧化钡溶液的溶质质量分数约为30%.
点评:在进行计算时需要考虑所滴加的稀硫酸一部分被生成的氢氧化钠所消耗.



 阅读快车系列答案
阅读快车系列答案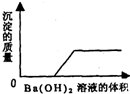 (1)某一由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液四种物质中的两种混合形成的混合溶液,现向该混合溶液中滴入氢氧化钡溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示.该混合溶液的组成是
(1)某一由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液四种物质中的两种混合形成的混合溶液,现向该混合溶液中滴入氢氧化钡溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示.该混合溶液的组成是